 Ievads
IevadsLATVIJAS UNIVERSUTĀTE
BIOLOĢIJAS FAKULTĀTE
AUGU FIZIOLOĢIJAS KATEDRA
Biostimulatoru ietekme uz linu sēklu dīgšanu
Kursa darbs
Darba autors Andis Karlsons stud. apl. Nr.- biol000017
Darba vadītājs Dr. biol., doc. Māra Vikmane
Katedras vadītājs Dr. hab. biol., prof. Ģederts Ieviņš
Recenzents Dr. biol., asoc. prof. Uldis Kondratovičs
RĪGA, 2002
Kopsavilkums
Darbā apkopoti pētījumu rezultāti par biostimulatora Germina un mikroelementu (cinka, vara un bora) ietekmi uz linu sēklu dīgšanu un zaļo plastīdu pigmentu daudzumu dīgļlapās
Darbā novērota biostimulatoru ietekme uz garšķiedras linu šķirnes Laura sēklu dīgšanu, veicot sēklu pirmssējas apstrādi, kā arī novērots vai biostimulatoru ietekme saglabājas nākošajā paaudzē.
Darba rezultātā noskaidrots, ka biostimulatoru ietekme uz linu sēklu dīgšanu ir sekojoša:
Eksperimenti veikti un darbs izstrādāts Latvijas Universitātes, Bioloģijas fakultātes, Augu fizioloģijas katedrā.
1.2 Sēklu dīgšana un fitohormonu loma tās regulācijā *
1.3 Zaļo plastīdu pigmentu un fotosintēzes endogēnā regulācija *
1.4 Augšanas stimulatora Germina raksturojums *
1.5 Mikroelementu vara, cinka un bora fizioloģiskā loma augos *
2.1 Izmantotā objekta un izmēģinājuma raksturojums *
2.3 Sēklu dīgšanas intensitātes, dīgtspējas un dīgšanas enerģijas noteikšana *
2.4 Zaļo plastīdu pigmentu kvantitatīvā daudzuma spektrofotometriska noteikšana *
3.1 Biostimulatoru ietekme uz linu šķirnes Laura sēklu dīgšanu *
3.1.1 Sēklu dīgšanas intensitāte *
3.1.4 Zaļo plastīdu pigmentu satura izmaiņas linu dīgstos biostimulatoru ietekmē *
Lini Latvijas lauksaimniecībā jau no seniem laikiem ieņēmuši nozīmīgu vietu. Tā ir viena no vecākajām augkopības nozarēm, kas agrāk tika audzēta visā Latvijas teritorijā. Mainoties saimnieciskajai situācijai, linu nozare nonāca sarežģītā stāvoklī, bet pašlaik linu nozares attīstība stabilizējas. Linu audzēšana ir perspektīva, jo izaudzētā raža dod preču produkciju, kura 85-90% apmērā tiek eksportēta un ir konkurētspējīga ES tirgū.Tālākai nozares attīstībai nepieciešams palielināt linu ražību un paaugstināt kvalitāti, līdz ar to samazināt pašizmaksu. Viens no veidiem kā to panākt ir izmantot dabīgos augšanas stimulatorus, kas ir vidi saudzējoši un neatstāj kaitīgu pēcdarbību. Tāpēc mana kursa darba mērķis ir noskaidrot mikrobioloģiskas dabas augšanas stimulatora Germina un mikroelementu (cinka, vara un bora) ietekmi uz sēklu dīgšanu, kā arī noskaidrot vai šī ietekme saglabājas nākošajā paaudzē.
Garšķiedras lini ir viengadīgs augs. To sakņu sistēmu veido mietsakne ar vāji attīstītām sānsaknēm. Stiebrs 75-135 cm garš, tievs, zarots tikai augšdaļā. Ziedi atkarībā no šķirnes, ir zili vai balti. Lini ir pašapputes augs, tomēr iespējama arī svešappute. Auglis ir 5 cirkņu pogaļa, kurā ar 5 sirpjveida papildsieniņām jeb septām katrs iecirknis sadalīts vēl divās daļās. Garšķiedras lini ir mērenā klimata augi, tādēļ tie ir samērā pieticīgi temperatūras ziņā. Linu sēklas sāk dīgt 3-5 °C temperatūrā, tomēr vispiemērotākā temperatūra dīgšanas laikā ir 9-12 °C (Holms, Sniedze, 1992).
Lini tautsaimniecībai dod divus vērtīgus produktus: šķiedru un eļļu. Linu šķiedra tekstilrūpniecības bilansē pēc kokvilnas ieņem otro vietu un ir viena no visstiprākajām un izturīgākajām augu šķiedrām. Linu sēklas satur 35-42% eļļas un līdz 23% olbaltumvielas. Eļļu galvenokārt izmanto medicīnā un tehniskajām vajadzībām (Ivanovs, Strakmale, 2001).
 1.2
Sēklu dīgšana un fitohormonu loma tās regulācijā
1.2
Sēklu dīgšana un fitohormonu loma tās regulācijā
Sēklu dīgšana sākas ar endospermas polimēru hidratāciju. Dīgšanu galvenokārt ietekmē ūdens daudzums vidē, mazāk - temperatūra, skābeklis un ogļskābā gāze.
Sēklu dīgšanā izšķir trīs galvenās fāzes:
Uzbriešanas fāzei raksturīga strauja ūdens uzņemšana sēklās. Lagfāzes laikā ūdens uzņemšanas intensitāte samazinās. Dīgļa vairodziņā, mitohondriju membrānās esošie fermenti aktivējas, pieaug elpošana un ATF sintēze. Vairodziņa epiteliālajās šūnās sāk funkcionēt H-sūknis, un vairodziņš izdala endospermā organiskās skābes. Endospermā palielinās to fermentu aktivitāte, kuri katalizē rezerves vielu šķelšanos, galvenokārt - lipāžu, proteāžu un amilāžu. Daži no šiem fermentiem, piem. a-amilāze, nav konstatēti sausās sēklās. Sausās sēklās atrodas arī t.s. preformētā mRNS, bet proteīnu sintēze sākas tikai pēc tam, kad, sēklai uzņemot ūdeni, ir izveidojušās polisomas. Jaunu proteīnu sintēze no aminoskābēm, kas izveidojušās rezerves proteīnu hidrolīzes rezultātā, ir ļoti nozīmīga sēklu dīgšanā (Полевой, 1989; Hartmann, 1990).
Vairodziņa sekretoro darbību aktivē citokinīni un auksīns, bet hidrolāžu sintēzi aleirona slānī iniciē giberelīni, inducējot mRNS sintēzi, kura kodē a-amilāzes un dažu citu amilāžu sintēzi. Giberelīni aleirona šūnās transportējas no dīgļa un vairodziņa. Giberelīni vispirms aktivējas dīglī, bet pēc dažām sakundēm giberelīnu sintēze inducējas arī vairodziņā. Lagfāzē arī aleirona slānis sāk izdalīt organiskās skābes un fermentus - galvenokārt hidrolāzes. Hidrolāžu darbības rezultātā izveidojušies cukuri, aminoskābes un citi savienojumi tiek izmantoti metabolisma procesos. Pēc tam dīgļsakne pati sāk sintezēt citokinīnus (Полевой, 1989).
R.Jann un R. Amen (1977) uzskata, ka citokinīniem sēklu dīgšanā ir palaišanas funkcija.
Dīgļsaknes parādīšanās ir šūnu augšanas, dalīšanās un stiepšanās fāžu rezultāts. Šūnu augšanas fāzes, tāpat kā rezerves barības vielu hidrolīzi, regulē fitohormoni (Hartmann, 1990).
Daudzās augu sugās citokinīni var izraisīt tādas pašas morfoloģiskas un bioķīmiskas izmaiņas kā gaisma. Citokinīniem un fitohromam ir ietekme uz sēklu miera periodu, dīgšanas procesiem, sējeņu attīstību un augšanas kinētiku, pigmentu veidošanos un fotoperioda regulāciju. Kopā ar fitohroma sistēmu citokinīni, iespējams, ir iesaistīti fotoperioda uztveršanā un cirkādisko ritmu uzturēšanā. Pastāv uzskats, ka gaisma un citokinīni varētu darboties neatkarīgi vai secīgi ar vienkāršu signālu starpniecību. Vēl nav noskaidrota šo signālu integrācija molekulārā līmenī (Thomas, 1997).
 1.3
Zaļo plastīdu pigmentu un fotosintēzes endogēnā regulācija
1.3
Zaļo plastīdu pigmentu un fotosintēzes endogēnā regulācija
Augu fitohormoniem ir ļoti dažāda ietekme uz fotosintēzi. Tā var būt tieša un netieša. Netiešā regulācija notiek ietekmejot auga augšanu un atīstību. Augšanas regulatori ietekmē asimilātu akceptoru atraģējošo darbību. Auga augšana un rezerves barības vielu uzkrāšana nosaka asimilātu transporta virzienu un ātrumu, tas savukārt nosaka asimilātu eksportu no hloroplastiem (Роньжина, 1993)
Augšanas regulatoru tiešā ietekme var būt divējāda. Tā var iedarboties uz hloroplastiem, aktivējot vai inhibējot fermentus, izmainot membrānu stāvokli, ģenerējot starpmembrānu potenciālu, ietekmējot fotofosforilācijas līmeni, kā arī mainot auga atvārsnīšu stāvokli. Šāda iedarbība neskar genomu vai plastomu. Taču fitohormoni var regulēt arī gēnu aktivitāti, transkripciju un translāciju, kura nosaka arī hloroplastu replikāciju un diferenciāciju (Мокроносов, 1981).
Arī T. Schmulling (1997) atzīmē, ka citokinīni kontrolē gēnu ekspresiju kā transkripcijas, tā translācijas līmenī. Šī kontrole, iespējams, notiek tikai konkrētos šūnu tipos. Bieži vien citokinīnu mērķa gēnus regulē arī papildus stimuli kā, piemēram, gaisma un auksīni. Šo gēnu produkti savukārt regulē šūnu dalīšanos, fotosintēzi, hlorolpastu attīstību, slimību rezistenci un barības vielu metabolismu.
Hloroplastu diferenciācijas hormonālā regulācija ir visai komplicēta. Vismaz četriem eksogēni pielietotiem fitohormoniem: citokinīniem, giberelskābei, abscizskābei un indolilsviestskābei konstatēta tieša ietekme uz hloroplastiem. Hloroplastu diferenciāciju fitohormoni ietekmē arī, veicinot vai kavējot dažādu vielu uzkrāšanos citoplazmā. Citokinīni ietekmē hlorofila sintēzi. Piem., apstrādājot augus ar benziladenīnu, krasi samazinās hlorofilāzes aktivitāte un pieaug hlorofila sintēze. Benziadenīns hlorofila veidošanos ietekmē, sekmējot proteīnu sintēzi. Tā ietekme uz lapām līdzinās sarkanās gaismas ietekmei. Iespējams, ka citokinīni regulē arī membrānu caurlaidību. Visplašāk izpētīta ir citokinīnu spēja aizkavēt hlorofilu noārdīšanos, īpaši auga novecošanās laikā. Konstatēts, ka citokinīni stimulē hloroplastu ultrastruktūru attīstību dīgļlapās - veidojas vairāk tilakoīdu un granu (Sundqvist, 1980).
Citokinīni palielina fotosintēzes intensitāti, palielinot lapās hlorofila daudzumu, veicinot hloroplastu attīstību vai mainot CO2 asimilācijas kapacitāti un fotosintēzes fermentu aktivitāti (Brenner, 1995)
 1.4
Augšanas stimulatora Germina raksturojums
1.4
Augšanas stimulatora Germina raksturojums
Germins sintezēts Latvijas ZA Mikrobioloģijas un Virusoloģijas institūtā biol. zin. diktores I. Miškes vadībā.
Citokinīnu dabas fitohormonu Germinu producē baktērija Pseudomonas stutzeri 136. Izmantojot spektroskopiskas, hromatografiskas un bioloģiskas metodes noskaidrots, ka Germina sastāvā ir 6 aminopurina oksikarbonskābes salikts esteris, kuram ir citokinīnu aktivitāte (Мишке, 1988).
Citokinīni aktivē šūnu augšanu, g.k. stimulējot stiepšanās fāzi (Полевой, 1989), regulē olbaltumvielu sintēzi gan transkripcijas gan translācijas līmenī, ietekmējot metabolisma procesus augos (Мокроносов, 1981; Роньжина, 1993; Schmulling, 1997)
Organisko vielu transportu augos, citokinīni regulē ietekmējot atraģējošo zonu aktivitāti (Мокроносов, 1981; Роньжина ,1993)
Viena no nozīmīgākajām citokinīnu lomām augos ir hlorofilu biosintēzes stimulācija un noārdīšnās aizkavēšana (Sundqvist, 1980;Полевой, 1989; Brenner, 1995)
Iepriekšējo gadu eksperimentos noskaidrots, ka Germinam piemīt arī elisitoru īpašības, kas palielina rezistenci pret fitopatogēniem (Strakmale,2001).
 1.5
Mikroelementu vara, cinka un bora fizioloģiskā loma augos
1.5
Mikroelementu vara, cinka un bora fizioloģiskā loma augos
Makroelementiem un mikroelementiem ir nozīmīga loma auga dzīvības norisēs. Trūkstot šādiem elementiem tiek traucēta augu uzbūves pamatvielu - aminoskābju, olbaltumvielu u.c. savienojumu sintēze vai arī fermenti un fitohormoni zaudē aktivitāti un bremzē dažādus fizioloģiskus un bioķīmiskus procesus (Riņķis, Ramane, 1989)
Varš ietilpst polifenoloksidāzes, askorbīnoksidāzes, laktāzes un citu fermentu sastāvā, tātad piedalās vai sekmē vairākus svarīgus augu dzīvības procesus- elpošanu, olbaltumvielu un ogļhidrātu vielmaiņu u.c. Vara ietekmē augos paaugstinās hidrofilo koloīdu daudzums, kas savukārt sekmē augu sausumizturību un salcietību. Varš palielina augu pretošanās spēju dažādām sēņu ierosinātām slimībām. Ja trūkst vara, uz augu lapām rodas gaiši plankumi un aizkavējas auga augšana (Marschner, 1995)
Cinks aktivē karboanhidrāzes, fosfatāzes u.c. fermentu darbību un tādējādi piedalās bioķīmiskajos procesos, kas saistīti ar oksidēšanās- reducēšanās reakcijām, olbaltumvielu, ogļhidrātu u.c. svarīgu vielu sintēzi. Cinks sekmē auksīna biosintēzi un stabilizāciju, šūnu citoplazmas viskozitātes palielināšanu. Visvairāk cinku vajag apaugļošanās procesos, jo cinks nepieciešams olšūnas un dīglīša attīstībai. Cinks pozitīvi ietekmē augu salizturību un sausumizturību (Riņķis, Ramane, 1989; Marschner, 1995)
Bors sekmē aminoskābju un olbaltumvielu sintēzi. Sevišķi liela nozīme boram ir ogļhidrātu sintēzē un vielmaiņā, lignīna kā šūnu komponenta biosintēzē kā ietekmē palielinās augu sausumizturība un salcietība. No bora trūkuma vispirms cieš vadaudu attīstība, tāpēc vielu pārvietošanās augos tiek traucēta. Asimilāti, kas izveidojas lapās, netiek aiztransportēti uz citām auga daļām un kavē fotosintēzes tālāko norisi. Ja bora trūkst, vispirms atmirst auga jaunās daļas, aizkavējas visu auga orgānu augšana, tiek pārtraukta sakņu, pumpuru un lapu normāla attīstība. sevišķi krasi bora trūkums atsaucas uz auga reproduktīvo orgānu veidošanos. Augi nezied vai noziedējuši neveido augļus. Liniem bora trūkums pastiprina uzņēmību pret bakteriozēm (Riņķis, Ramane, 1989 ; Marschner , 1995)
Darba mērķis bija noskaidrot, kā biostimulatori - Germins un mikroelementi ( cinks, varš un bors ) ietekmē linu sēklu dīgšanu kā arī vai šī iedarbība saglabājas nakošajā paaudzē (impritings). Mērķa sasniegšanai, tika izvirzīti sekojoši darba uzdevumi.
Noteikt biostimulatoru ietekmi uz linu sēklu :
Izmēģinājumi veikti un darbs izstrādāts LU Bioloģijas fakultātē Augu fizioloģijas katedrā 2002.gadā.
Darbā izmantotas Latgales Lauksaimniecības zinātnes centrā audzētas linu šķirnes Laura sēklas, kas ievāktas 2001. gadā.
 2.1
Izmantotā objekta un izmēģinājuma raksturojums
2.1
Izmantotā objekta un izmēģinājuma raksturojums
Darbā izmantota garšķiedru linu (Linum usitatissium L.) šķirne Laura. Auga stumbra Garums 60- 120 cm. Lapas veselas ar gludu malu, pamīšus, sēdošas, bez pielapēm. Ziedkopa skraja. Vainaglapas baltas. Vidējā salmiņu raža 7.27 t/ha, sēklu - 1.18 t/ha. Veldres izturība ļoti laba : 5 balles (Augu šķirņu salīdzināšanas rezultāti, 1999).
|
1.sērija. Sēklu tiešā apstrāde ar biostimulatoriem |
|
||||
|
1. Kontrole |
2. Germins |
3. ZnB |
4. CuB |
5. ZnB+ Germins |
6. CuB+ Germins |
|
2. sērija. Sēklu apstrādes ar biostimulatoriem iedarbības saglabāšanās nākošajā paaudzē pārbaude |
|||||
|
|
|
|
|
|
|
|
7. Kontrole |
8. Germins |
9. ZnB |
10.CuB |
11. ZnB+ Germins |
12. CuB+ Germins |
Variantu bioloģisko atkārtojumu skaits - 3. Katrā atkārtojumā - 100 sēklu.
Pirmās sērijas variantu sēklas apstrādā ar biostimulatoriem, savukārt kontroles un otrās sērijas ( sēklas ievāktas no augiem , kuri iepriekšējā gadā apstrādāti ar attiecīgo biostimulatoru) variantu sēklas diedzē destilētā ūdenī.
Pirmās sērijas variantu (3.,4.,5.,6.) sēklu apstrādei izmantoja 0.37 mg sīkdispersu cinka un vara borāta savienojumu uz 100 sēklām. Sēklu apstrādi veic svarglāzītē ar vāku. Lai sēklas vienmērīgāk pārklātos, pēc mikroelementu pievienošanas trauku ar sēklām intensīvi krata. Pēc tam 3. un 4. varianta sēklas ievieto Petri platē, kas izklāta ar diviem filtrpapīru apļiem, un samitrināja ar 5 ml destilēta ūdens Katru Petri plati apsedz ar vienu filtrpapīra apli. 5. un 6. variantu sēklas samitrina ar 5 ml Germina šķīduma (1ml standarta šķīduma atšķaida ar 200 ml destilēta ūdens).
Kontroles (1.,7.) un otrās sērijas variantu (8.,9.,10.,11.,12.) sēklas samitrina ar 5 ml destilēta ūdens.
Sēklas diedzē tumsā ~ 22º C temperatūrā. Lai sēklas neizžūtu, filtrpapīra tiltiņš savieno Petri plates filtrpapīra apļus ar destilēta ūdens trauciņu. Ūdens iztvaikošanas ierobežošanai platei uzlikts vāciņš atstājot nelielu spraugu gaisa cirkulācijai. Sēklu dīgšana tika pārbaudīta ik pēc 24 stundām.
 2.3
Sēklu dīgšanas intensitātes, dīgtspējas un dīgšanas enerģijas noteikšana
2.3
Sēklu dīgšanas intensitātes, dīgtspējas un dīgšanas enerģijas noteikšana
Dīgšanas intensitāte tika noteikta saskaitot sadīgušās sēklas, ik pēc 24 stundām, kā arī pārrēķinot procentos attiecībā pret sēklu kopskaitu katrā variantā. Sēkla tiek uzskatīta par uzdīgušu kad tās asna garums sasniedz 2mm garumu.
Dīgšanas enerģija raksturo dīgstu parādīšanās ātrumu un vienmērīgumu. To aprēķina procentos, dalot katra varianta pirmajā dienā sadīgušo sēklu skaitu ar vispār sadīgušo sēklu skaitu attiecīgajā variantā (Indriksons, 1982).
Dīgtspēja ir procentuāli sadīgušo seklu skaits katrā variantā.
 2.4 Zaļo plastīdu
pigmentu kvantitatīvā daudzuma
spektrofotometriska noteikšana
2.4 Zaļo plastīdu
pigmentu kvantitatīvā daudzuma
spektrofotometriska noteikšana
Uz Torsija svariem nosver 30-40 mg augu materiāla ievieto piestiņā, pievieno nedaudz CaCO3, aptuveni 1 ml šķīdinātāja - 100% acetona un berž, līdz izveidojas viendabīga masa. Nelielām porcijām pievieno šķīdinātāju un saberzto masu kvantitatīvi pārnes graduētā mēģenē, uzpilda to līdz 10 ml tilpumam un pēc tam pārlej centrifūgas stobriņā, centrifugē 3-5 min. (5000 apgr./min)
Spektrofotometriski (СФ- 26) nosaka šķīduma optisko blīvumu gaismas viļņu garumos, kas atbilst hlorofila a (662nm), hlorofila b (644nm) un karotinoīdu (440.5nm) absorbcijas maksimumiem. Pigmentu koncentrāciju aprēķina pēc D.Wettsteina formulas.
Hla = 9.784 × D662 - 0.990 × D664
Hlb = 21.426 × D644 4.650 × D662
Ck = 4.695 × D440.5 0.268 × Ca + b
A=C·V(1000·m)-1
C- pigmentu koncentrācija, mg/l
V- pigmentu izvilkuma tilpums, ml
m- augu materiāla iesvars, g (citēts pēc Vikmane, 2002)
Zaļo plastīdu pigmentu kvantitatīvai noteikšanai varianta kopējais atkārtojumu skaits 6 (divi paraugi no katra bioloģiskā atkārtojuma).
Dažādu apstrādes variantu rezultātu
salīdzināšanai veikta rezultātu matemātiskā apstrāde (vidējais
aritmētiskais, standartkļūda), izmantojot datorprogrammu (Microsoft
Excel).
3.1 Biostimulatoru ietekme uz linu šķirnes Laura sēklu dīgšanu
3.1.1 Sēklu dīgšanas intensitāte
Sēklas maksimālo dīgtspēju sasniedza pēc 3 diennakšu ekspozīcijas laika.
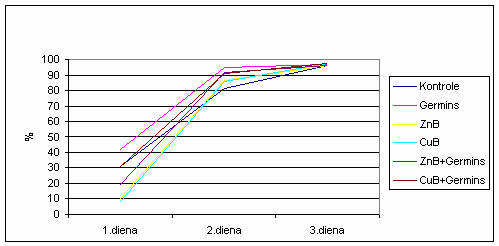 Kā redzams 1. sērijas
izmēģinājumos vislabākā linu sēklu dīgšanas intensitāte gan pirmajā gan
otrajā dienā novērota variantam, kura sēklas apstrādātas ar Germinu.
Pārējie varianti pirmajā dienā uzrādījuši sliktāku rezultātu kā
kontroles variants, izņemot variantu CuB+Germins, kura sēklu dīgšanas
intensitāte vienāda ar kontroli. Savukārt jau otrajā dienā visas
apstrādātās sēklas uzrādījušas augstāku dīgšanas intensitāti nekā
kontroles varianta sēkla (īpaši Germina variantā, kura sēklu dīgšanas
intensitāte bija par 13% augstāka).
Kā redzams 1. sērijas
izmēģinājumos vislabākā linu sēklu dīgšanas intensitāte gan pirmajā gan
otrajā dienā novērota variantam, kura sēklas apstrādātas ar Germinu.
Pārējie varianti pirmajā dienā uzrādījuši sliktāku rezultātu kā
kontroles variants, izņemot variantu CuB+Germins, kura sēklu dīgšanas
intensitāte vienāda ar kontroli. Savukārt jau otrajā dienā visas
apstrādātās sēklas uzrādījušas augstāku dīgšanas intensitāti nekā
kontroles varianta sēkla (īpaši Germina variantā, kura sēklu dīgšanas
intensitāte bija par 13% augstāka).
 3.1.1.1 att. 1.sērija linu
sēklu dīgšanas intensitāte.
3.1.1.1 att. 1.sērija linu
sēklu dīgšanas intensitāte.
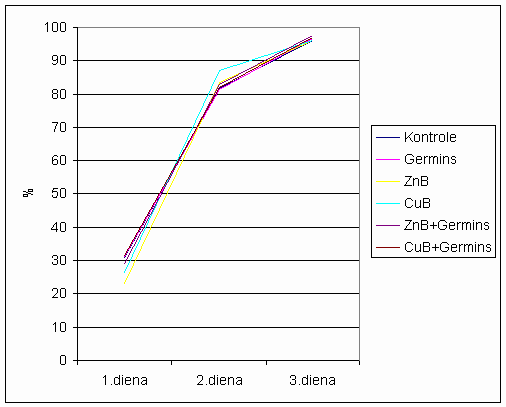
3.1.1.2 att. 2.sērija linu sēklu dīgšanas intensitāte.
2. sērijas rezultāti pierāda, ka nav novērojama nekāda pēcdarbība, jo visu variantu sēklas ir ar gandrīz vienādu dīgšanas intensitāti.
Nosakot sēklu dīgtspēju, konstatējām, ka ne fitohormons Germins, ne mikroelementi cinka borāts un vara borāts kā arī šo biostimulatoru kombinācijas nav būtiski ietekmējušas sēklu dīgtspēju, jo novērojamās atšķirības ir kļūdu robežās.
Konstatējām arī ka nav novērojama biostimulatoru iedarbība nākošā gada linu sēklās uz to dīgtspēju.
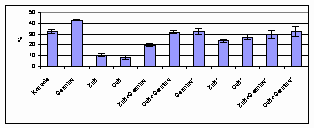 Nosakot linu sēklu dīgšanas
enerģiju konstatējām, ka fitohormona Germina ietekmē tā palielinājusies
par 10.6 % (1. sērijā) salīdzinot ar kontroli. Germina tiešā ietekme
(1. sērija) ir daudz izteiktāka nekā pēcdarbība. Literatūrā ir norādes,
ka citokinīniem sēklu dīgšanā ir palaišanas loma (skat. darba 5.
lpp.) Arī mūsu eksperiments apstiprina, ka Germinam, kā citokinīnu dabas savienojumam ir šādas funkcijas.
1.sērijas eksperimentā mikroelementu tiešās ietekmes rezultātā sēklu
dīgšanas enerģija samazinājās par 21.9 % (cinka borāts) un 23.8 %(vara
borāts) salīdzinot ar kontroles variantu. Šāda tendence saglabājas arī 2. sērijas eksperimentā. Mikroelementu un
Germina kombinācijās negatīvā ietekme mazāk izteikta.
Nosakot linu sēklu dīgšanas
enerģiju konstatējām, ka fitohormona Germina ietekmē tā palielinājusies
par 10.6 % (1. sērijā) salīdzinot ar kontroli. Germina tiešā ietekme
(1. sērija) ir daudz izteiktāka nekā pēcdarbība. Literatūrā ir norādes,
ka citokinīniem sēklu dīgšanā ir palaišanas loma (skat. darba 5.
lpp.) Arī mūsu eksperiments apstiprina, ka Germinam, kā citokinīnu dabas savienojumam ir šādas funkcijas.
1.sērijas eksperimentā mikroelementu tiešās ietekmes rezultātā sēklu
dīgšanas enerģija samazinājās par 21.9 % (cinka borāts) un 23.8 %(vara
borāts) salīdzinot ar kontroles variantu. Šāda tendence saglabājas arī 2. sērijas eksperimentā. Mikroelementu un
Germina kombinācijās negatīvā ietekme mazāk izteikta.
3.1.3 att. Linu sēklu dīgšanas enerģija (*-biostimulatoru ietekmes saglabāšanās pārbaude).
Tiešās sēklu apstrādes rezultātā, iespējams, ka mikroelementi ietekmē membrānu transportu, saistoties aktīvajos centros, tādējādi inhibējoši iedarbojoties uz sēklu dīgšanas enerģiju (Ткачук, Кузменко, 1991).
2. dienā pēc sēklu sadīgšanas mikroelementi stimulē sēklu dīgšanu (3.1.1.1 att.). Iespējams, ka tie iesaistās metabolisma reakcijās un inhibējošā ietekme pāriet stimulējošā. Šī inhibējošā ietekme neatstāj paliekošu ietekmi uz sēklu dīgtspēju (3.1.2 att.).
 3.1.4
Zaļo plastīdu pigmentu satura izmaiņas linu dīgstos biostimulatoru
ietekmē
3.1.4
Zaļo plastīdu pigmentu satura izmaiņas linu dīgstos biostimulatoru
ietekmē
Zaļo plastīdu pigmentu daudzums dīkstu dīgļlapās noteikts pēc 5 diennakšu ekspozīcijas laika. Kā jau minēts viena no citokinīnu darbības izpausmēm augos novērš hloroplastu destrukciju un hlorofila noārdīšanos.
1. sērijas eksperimentā pierādījās, ka biostimulatori stimulējoši iedarbojas uz pigmentu daudzumu augā.
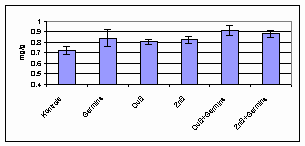
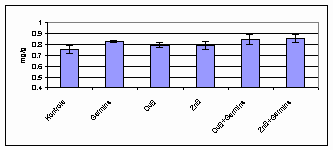 Attiecībā uz hlorofilu a
ietekme gan nav sevīšķi būtiska, izņemot Germinu pārējo variantu
atšķirības ir kļūdu robežās, bet ir vērojama tendence, ka visi
biostimulatori pozitīvi ietekmē hlorofila a daudzumu dīgļlapās (att.
3.1.4.1.).
Attiecībā uz hlorofilu a
ietekme gan nav sevīšķi būtiska, izņemot Germinu pārējo variantu
atšķirības ir kļūdu robežās, bet ir vērojama tendence, ka visi
biostimulatori pozitīvi ietekmē hlorofila a daudzumu dīgļlapās (att.
3.1.4.1.).
3.1.4.1. att. Hlorofila a daudzums linu dīgļlapās.
 Hlorofila b daudzums dīgļlapās
biostimulatoru ietekmē palielinās visai ievērojami, sevišķi fitohormona
Germina un mikroelementu kombināciju ietekmē.
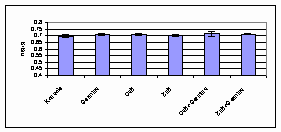
Hlorofila b daudzums dīgļlapās
biostimulatoru ietekmē palielinās visai ievērojami, sevišķi fitohormona
Germina un mikroelementu kombināciju ietekmē.
3.1.4.2. att. Hlorofila b daudzums linu dīgļlapās.
 Vērojama tendence, ka
karotinoīdu daudzums palielinās to linu dīgstu dīgļlapās, kuru sēklas
pirms sējas apstrādātas ar biostimulatoriem.
Vērojama tendence, ka
karotinoīdu daudzums palielinās to linu dīgstu dīgļlapās, kuru sēklas
pirms sējas apstrādātas ar biostimulatoriem.
3.1.4.3. att. Karotinoīdu daudzums linu dīgļlapās.
Karotinoīdu daudzuma izmaiņas linu dīgļlapās (līdzīgi kā hl a gadījumā) ir samērā niecīgas un nav uzskatāmas par būtiskām