
Multigēnās slimības ir ģenētiskas slimības, bet tās neiedzimst pēc Mendeliskajām likumsakarībām. Šīs slimības saistītas ar vairākām riska alēlēm. Katras alēles noteiktais fenotips it kā summējas ar pārējo alēļu noteiktajiem fenotipiem un rezultātā izveido indivīda fenotipu. Zināma loma, protams, ir arī vides faktoriem. Pie multigēnajām slimībām pieskaita astmu, sirdsslimības (agrā vecumā), 2. tipa cukura diabētu, Alcheimera slimību, osteoartrītu un dažādas garīgās slimības. [22]

II tipa cukura diabēts, tā radītās veselības komplikācijas un iesaistītie gēni.
Diabetes mellitus (gr. diabetes tecēt cauri, lat. mel medus) jeb cukura diabēts ir hroniska vielmaiņas slimības. Insulīna rezistence ir pirmā pazīme, kas liecina par II tipa diabēta attīstības sākumu. Insulīna rezistences iemesls visbiežāk ir aptaukošanās. Lielākā daļa II tipa diabēta pacientu ir korpulenti. Aizkuņģa diedzera b šūnas cenšas pielāgoties insulīna rezistencei, izdalot palielinātu insulīna daudzumu, tādējādi ļaujot aknām un muskuļiem darboties normāli. Diemžēl aizkuņģa dziedzeris ne vienmēr var saražot pietiekami daudz insulīna, lai kompensētu tā rezistenci. Tam seko traucēta glikozes tolerance, hiperglikēmija pēc glikozes slodzes un visbeidzot hiperglikēmija tukšā dūšā. Paaugstināts glikozes līmenis asinīs aizkuņģa dziedzera beta šūnām ir toksisks (šīs šūnas sintezē insulīnu) un tāpēc stāvoklis vēl vairāk pasliktinās. Palielināts glikozes līmenis asinīs izraisa mikrovaskulārās izmaiņas un veicina aterosklerozes attīstību. (1.)
Cukura diabēts divas līdz septiņas reizes palielina risku saslimt ar sirds, galvas un perifēro asinsvadu slimībām. (2.)
Insulīna terapija ievērojami palielina pacientu dzīves ilgumu, tomēr tā nevar pilnībā novērst visus vielmaiņas traucējums. Hiperglikēmijas apstākļos pastiprinās glikoproteīdu un mukoproteīdu sintēze. Depolimerizējoties saistaudu aminopolisaharīdiem, asinsvadu sieniņās palielinās poras un tajās izgulsnējas lielmolekulārie savienojumi b-lipoproteīdi, holesterīns u. c. līdz ar to sabiezinās kapilāru bazālās membrānas un ievērojami straujāk attīstās ateroskleroze, mikro- un makroangiopātijas. Tās var izpausties dažādos veidos:
II tipa cukura diabēts lielā mērā ir iedzimta slimība. Divu diabētiķu pēcnācēji 80 % gadījumu saslimst ar diabētu. Diabētiķiem raksturīgi, ka vidēji par 50% samazinās jūtīgums pret insulīnu un par 50 70% samazinās glikogēna sintēze un uzglabāšana. Tāpat kā insulīna rezistence, arī šis glikogēna sinēzes defekts ir novērojams 2. tipa diabēta slimnieku asinsradiniekiem. Sastopamas arī vairākas aizkuņģa dziedzera beta šūnu disfunkcijas formas.
Kaut arī ir skaidrs, ka aptaukošanās var iespaidot II tipa diabēta rašanos, tam nav atrasti nekādi ģenētiski pierādījumi. Kaut arī ir tikai nelieli aizkuņģa dziedzera beta šūnu bojājumi, aptaukošanās gadījumā var rasties smaga insulīna rezistence. Ir pierādīts, ka cilvēkam ar iedzimtu risku saslimt ar II tipa cukura diabētu aptaukošanās gadījumā šis risks palielinās cilvēks saslimst agrāk.
Ļoti daudzu gēnu saistība ar II tipa diabētu ir pētīta ar ģenētisko marķieru palīdzību. Piemēram, muskuļu glikonēga sintāzes gēns (muscule glycogen synthase), aminoskābju izmaiņas glikagona receptora gēnā (glucagon receptor), insulīna receptora substrāta (IRS-1) gēns (insulin receptor substrate), sulfonilurīnvielas receptora gēns (sulfonylurea receptor). Tā kā šo pētījumu rezultāti bieži vien ir negatīvi vai maz ticami, tad bieži lieto nelīdzsvarotas gēnu iedzimtības pētījumus (linkage dissequilibrium analyses)
Lielākā daļa II tipa cukura diabēta formu neiedzimst pēc Mendeļa likumiem, no tā var secināt, ka šī ir multigēna slimība. Atsevišķi var izdalīt II tipa cukura diabētu, kas sākas pirms 25 gadu vecuma (MODY maturity onset diabetes of the young), jo tas autosomāli dominanti iedzimst lielākajā daļa ģimeņu. Pretēji lielākajia daļai diabētiķu, šiem pacientiem nav palielināts svars un viņiem ir defekti insulīna sekrēcijā, bet pats insulīns ir ar normālu aktivitāti.
Visus ar diabētu saistītos gēnus varētu
iedalīt divās daļās: gēni, kas saistīti at insulīna aktivitāti un gēni,
kas ir iesaistīti insulīna sintēzi kontrolējošajos signālceļos. (4.)

Signālceļi var būt ļoti dažādi, tomēr
tie pakļaujas vieniem un tiem pašiem principiem. Ligandes izspiežas
cauri plazmatiskajai membrānai vai arī piesaistās pie membrānu
receptoriem, tādējādi tos aktivējot. Aktivētie receptori sadarbībā ar
signālu pārnesējiem (transduceriem) var aktivēt efektorus vai nu tieši
vai arī mainot sekundāro mesendžeru daudzumu šūnā. Savukārt sekundārie mesendžeri aktivē mērķproteīnus, kas vai
nu tieši vai arī aktivējot citus proteīnus, maina gēna ekspresiju. Mērķa
proteīni var ietekmēt arī signālu pārnesējus (transducerus) un/vai
receptorus, izslēdzot tos. Lielākā daļa protoonkogēnu kodē kādu no šī
ceļa proteīniem ligandi, receptori, signālu pārnesēji (transduceri),
efektori. Lielākā daļa signālceļu proteīnu aktivitāte tiek regulēta ar
ligandu vai sekundāro mesendžeru piesaistīšanos, kā rezultātā notiek
kovalentas izmaiņas un subvienību konformācijas vai skaita maiņas. Lielākā daļa novēroto
kovalento modifikājciju ir tirozīna (Tyr) vai serīna/treonīna (Ser/Thr)
atlikumu fosforilēšana. Šādu fosforlēšanu katalizē enzīmi
proteīnkināzes, līdz ar to proteīnkināzes ir būtisks posms signālu
pārnesē. Gan Tyr, gan Ser/Thr
specifiskās kināzes un to proteīnu substrāti ir daudzu signālceļu
komponenti. Turklāt dažas proteīnkināzes pašas ir substrāti citām
proteīnkināzēm vai arī tās aktivē sevi ar autofosforilēšanās reakcijām.

Divas svarīgākās Ser/Thr specifiskās
kināzes ir cikliskā AMP (cAMP) atkarīgā proteīnkināze A (PKA) un kalcija
un fosfolipīdu aktivēto proteīnkināžu C (PKC) grupa. PKC ir būtiski
enzīmi signālu pārnesē, jo tās pārstāv mērķproteīnus forbola estera
iedarbībai. Forbola esteris ir substance, kas dramatiski iejaucas ar vairošanos un
diferencēšanos saistītos notikumos, veicinot onkogēniskas
transformācijas šūnās gan in vivo, gan in situ. PKC izoenzīmus kodē liela gēnu grupa, šie
izoenzīmi atšķiras gan pēc struktūras, gan pēc audu specifiskuma, kur
darbojas, gan aktivācijas veida, gan specifiskā substrāta substrāta.

Pirmā PKC, ko atklāja, bija histonu proteīnkināze, ko var aktivēt ar ierobežotu proteolīzi, Ca2+ un fosfoloipīdiem vai forbola esteriem un fosfolipīdiem. Trīs galvenās PKC izoformas ir a,b un g, bet pavisam kopā ir deviņas. Tās atklāja klonējot cDNS. Visas PKC var iedalīt 2 grupās - Ca2+-atkarīgās jeb klasiskajās (conventional) cPKC un Ca2+-neatkarīgās jeb jaunās (novel) nPKC. a, bI, bII un g ir Ca2+-atkarīgās, bet d,e, z, h un q ir Ca2+-neatkarīgās PKC.
Visām PKC ir funkcionālie domēni (C1-C4) un varibalie domēni (V1-V5) (1. attēls). PKC enzīmu molekulas veido tikai viena subvienība (viena proteīnu molekula). nPKC un cPKC struktūras atšķiras, bet ir vērojama kopīga iezīme C-gala rajonā (C3-V5) visiem PKC izoenzīmiem atrodas katalītiskais domēns, ko no regulatorā domēna atdala V3. N-gala V1 reģions cPKC ir neliels (~20 aminoskābes) un tam nav īpašas nozīmes, toties nPKC tas var būt liels un var ietekmēt vai pat mainīt pārējo reģionu funkcijas. Domājams, ka C2 reģionam ir loma Ca2+ saistīšanā. Šis reģions ir jūtīgs pret proteolītisko šķelšanu ar tripsīnu un Ca2+-atkarīgajām dabiskajām proteāzēm kalpaīna I un kalpaīna II. PKC a ir izturīgāka pret proteolītisko šķelšanu nekā PKC b un g. C3 reģionā atrodas ATF saistīšanās vieta, kura praktiski visām PKC ir vienāda, izņemot PKC g. C4 rajons satur substrāta saistīšanās vietu un fosfāta pārneses rajonu.
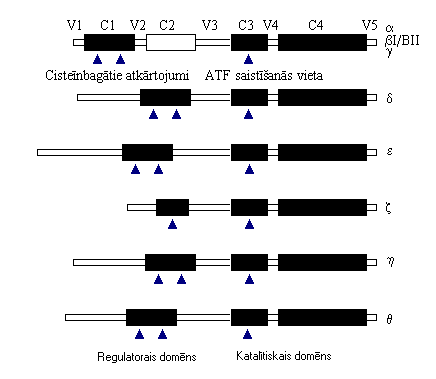
1. attēls. PKC izoenzīmu domēnu struktūra (5)
PKC a, bI,bII, d, e un z ir sastopamas gandrīz visos audos smadzenēs, plaušās, liesā, aizkrūtes dziedzerī un ādā. PKC g ir atrasts CNS smadzenēs, PKC h ādā, plaušās un nedaudz smadzenēs un liesā. PKC q pārsvarā ir skeleta muskuļos, bet nelielā daudzumā sastopams arī pārējos audos.
Dažādi PKC izoenzīmi ir sastopami dažādos audos un dažādos daudzumos. Praktiski visi izoenzīmi ir sastopami smadzenēs, bet to daudzums un skaits citos orgānos ir stipri atšķirīgs. PKC a, bI un bII ir gandrīz visos audos un šķiet, ka tie var viens otru aizvietot, tiem mēdz būt diezgan līdzīgas funkcijas.
Dažādi PKC izoenzīmi ir ne tikai audu
specifiski, bet to skaits un daudzums šūnā var mainīties atkarībā no
šūnas attīstības fāzes. Tas nozīmē, ka dažādi izoenzīmi ir nepieciešami,
lai notiktu pareiza proliferācija un diferenciācija un saglabātos
pareizas audu īpašības. (5.)

Proteīnkināžu Cb iespējmā saistība ar II tipa cukura diabētu un diabētiskajām komplikācijām
Nav īsti skaidrs, vai specifiskās PKC izoformas ir nepieciešamas insulīna stimulētajā glikozes trasnportā. Ja normālas PKC bII vietā ekspresējas defektīva PKC bII (ar delēciju telrminālā gala V5 reģionā) vai tiek lietots semiselektīvais PKC bII inhibitors (CG53353), tad tiek inhibēts insulīna stimulētais glikozes transports. [8 Antras] PKC mutantai formai M217 ar delēciju V5 reģionā (trūkst 9 aminoskābes) ir samazināta autofosforilācijas aktivitāte (katalītiskā aktivitāte), tādējādi insulīna stimulētā 2-dezoksiglikozes (2-DOG) uzņemšna šūnās samazinās par 45%. Līdzīgi mutanti ar delēcijiem V5 reģionā M216 (trūkst 52 aminoskābes) un M218 (trūkst 13 aminoskābes) pilnībā zaudējusi katalītisko aktivitāti. M217 ar natīvo PKC bII nekonkurē par kofaktoriem vai aktivatoriem, bet par substrātu un/vai iekššūnas receptoriem. [9 Antras] Glikozes transportproteīns (kanāls) 4 (GLUT 4) ir nozīmīga molekula glikozes transportā. Aktivēts PKC piedalās GLUT 4 saturošo vezikulu translokācijā no citoplazmas uz ārējo šūnas membrānu. Insulīns veicina šo procesu. PKC inhibitora peptīds (PKC19-36) pilnībā inhibē insulīna paaugstināto proteīnkināzes aktivitāti un insulīna regulēto GLUT 4 translokāciju no iekšējās membrānas uz plazmatisko membrānu. [7 Antras] Pieaugot endotēlija glikozes transportiera (GLUT 1) pārekspresijai, glikozes uzņemšana paaugstinās un līdz ar to pieaug arī PKC aktivitāte. [10 Antras]
PKC bII ir saistīts ar insulīna rezistenci un diabētisko komplikāciju izraisīšanu. [8 Antras] PKC aktivēšanos var izraisīt dažādi aģenti augsts glikozes līmenis, taukskābes vai insulīns. Aktivēta PKC inhibē insulīna receptora tirozīna kināzes (IRK) aktivitāti. Samazināta IRK aktivitāte pavājina insulīna signāla pārvadāšanu, un tas savukārt veicina insulīna rezistenci. Domājams, ka IRK aktivitātes inhibīciju izraisa noteiktu serīna vai treonīna atlikumu fosforilēšana insulīna receptora (IR) b-subvienībā. Nav īsti skaidrs kurš no PKC izoenzīmiem iesaistīts insulīna receptora inhibēšanā, bet novērojumi liecina, ka PKC bI un PKC bII IR autofosforilāciju kavē par 45 50%. [6 Antras]
Citu autoru darbos sacīts, ka
PKC b nav
nepieciešams insulīna stimulētajā glikozes transportā. Audos, kuros
izslēgta PKC b ietekme, glikozes transports palielinās,
turklāt PKC bI negatīvi iekmē insulīna stimulēto GLUT 4
translokāciju, tādējādi kavējot glikozes transportu. Inhibējot PKCb II vai citus
DAG-jūtīgus PKC, var uzlabot diabētiskās komplikācijas un arī samazināt
insulīna rezistenci [8 Antras].

Proteīnkināzes C b (PRKCB1) gēna struktūra un alternatīvais splaisings.
PKC b I un PKC b II izoenzīmus kodē viens un tas pats gēns PRKCB1. Gēna cDNS nukleotīdi 1-2061 ir kopīgi gan b I, gan b II, bet sākot ar 2062 nukleotīdu ir vērojamas atšķirības starp PKC b I- un b II-specifiskām sekvencēm [1 Antras].
Noskaidrots, ka selektīvās poliadenilācijas, mRNS stabilitātes un mRNS transporta līmenī notiekošā regulācija nespēlē nozīmīgu lomu diferenciālajā PKC b I un PKC b II ekspresijā. Tas liecina, ka galvenā nozīme dažādu mRNS sintēzē ir alternatīvajam. [2 Antras]
Par to, kas un kā ietekmē diferenciālo splaisingu, īstas skaidrības vēl nav, un dažādu autoru sniegtā informācija mēdz būt pretrunīga.
Pastāv uzskats, ka PKC b ir iesaistīts insulīn-stimulētajā glikozes transportā. PKC b I un PKC b II līmenis šūnā reaģē uz insulīnu un tiem ir dažādas funkcijas. Insulīna klātbūtne palielina nobriedušās PKC b IImRNS līmeni, bet nekādi neietekmē nobriedušās PKC b I mRNS līmeni. PKC b II mRNS daudzuma palielināšanās atspoguļojas proteīnu līmenī. PKC b II mRNS daudzuma palielināšanās insulīna ietekmē nav saistīta ne ar transkripcijas aktivitātes, ne arī mRNS stabilitātes palielināšanos. (6)
Savukārt BC3H-1 miocītos ir atklāts, ka insulīns iesaistīts PKC b mRNS alternatīvā splaisinga regulācijā, tādējādi pārslēdzot ekspresiju no PKC b I uz PKC b II mRNS. Insulīna ietekmē notiek strauja PKC b I mRNS pazušana, tās daudzums samazinās par 75%, turpretī PKC b II kļūst par galveno splaisinga produktu, kas skaidrojams ar b I mRNS destabilizāciju. Šo efektu novēro jau 15 minūtes pēc apstrādes ar insulīnu, turklāt iedarbība ir atkarīga no pielietotās insulīna devas (min 0,2 nM). Pārslēgšanos konstatē ar PKC b II proteīna daudzuma palielinšanos. Tādējādi insulīns regulē PKC b gēna alternatīvo splaisingu. [2]
PKC b gēnu alternatīvo splaisingu ietekmē arī TPA (12-0-tetradekanol-forbol-13-acetāts). Apstrāde ar zemas koncentrācijas TPA par 50% paaugstina b I mRNS līmeni, jo TPA inducē gēna bazālo promoteri. Tomēr pie 1-5 µM TPA koncentrācijām alternatīvais splaisings tiek pārslēgts no b I uz b II. [2]
Atšķirībā no PKC b I, PKC b II palielināta ekspresija veicina mitogēn-aktivētās kināžu kaskādes, glikogēnkināzes sintāzes 3b, insulīna receptora darbības aktivēšanos/inaktivēšanos, šūnu proliferāciju, proteīnu transportu, apaptozi un glikozes tansportu. (7.)
Gan SR (serīn-arginīn bagātie rajoni) hiper-, gan hipofosforilācija ietekmē splaisingu. SRp40 (serīn-arginīn bagaātais 40 kD proteīns splaisinga) insulīna klātbūtnē var tikt fosforilēts ar fosfatidilinozitolsa 3-kināzes atkarīgā ceļa aktivāciju. (7)
Insulīns regulē PKC bII alternatīvo splaisingu neatkarīgi no augšanas un diferenciācijas. (7)
Insulīna loma alternatīvajā splaisingā
ir mRNS splaisinga kompleksam nepieciešamo splaisinga faktoru
regulēšana, tos inducējot. Alternatīvais splaisings ietver splaisinga
saitu pārslēgšanos mRNS procesēšanas laikā. mRNS alternatīvā splaisinga
produkts-proteīns, ir būtisks
iekšūnas signālu komponents insulīnam, jo šūnas spēja atbildēt uz
insulīna signāliem ir atkarīga no vienas vai otras PKC b izoformas
klātbūtnes, un izoformu ekspresiju regulē insulīns. Stimulējot šūnas ar
insulīnu, palielinās diacilglicerola daudzums un tas aktivē dažus PKC
izoenzīmus. Lai gan atšķirīgu PKC b transkriptu ekspresija ir atkarīga no
attīstības stadijas vai šūnas tipa, šūna var mainīt ekspresiju no viena
alternatīvā splaisinga produkta uz otru šī peptīdu hormona ietekmē,
tādējādi mainot metaboliskos ceļus [2].

Visizplatītākais ģenētisko variāciju tips ir viena nukleotīda polimorfisms jeb SNP (single nucleotide polimorphism). Aptuveni 90% no sekvenču variācijām izraisa SNP. Uz apmēram 1000 bāzēm ir viens SNP [15], bet pēc citu autoru datiem pat uz katrām 200 300 bāzēm ir pa vienam SNP. [16]
Iedzimtās slimības visbiežāk ir saistītas tieši ar viena nukleotīda polimorfismu. Visbiežāk mutācijas dēļ ir izmainīta proteīna stabilitāte, tas funkcionē pārāk mazu vai lielu laiku, ietekmējot kopējās bioķīmiskās norises šūnā. Kā tieši tas izraisa slimību, īsti nav skaidrs. Visticamākais, ka SNP ietekmē gēna funkcijas, atrodoties kodējošos un regulatoros reģionos. Vidēji katra gēna sastāvā ir 4 cSNP (SNP gēna kodējošajā daļā), kuru frekvence populācijā ir vismaz 1%. cSNP izraisa missense mutācijas (aminoskābes nomaiņu) atbilstošajā proteīnā. Mutāciju dēļ var rasties kādas individuālas iezīmes, piemēram, mainās uzņēmība pret slimībām vai reakcija uz zālēm, bet var gadīties arī, ka mutācijas neizraisa nekādas fenotipiskas izmaiņas. Missense mutācijas izraisa apmēram pusi no visām ģenētiskajām slimībām, gan monogēnās, gan poligēnās slimības sirds slimības un hipertensija. [15]
Missense mutācijas ietekmē:
I Proteīnu stabilitāti. To izraisa 1) vienas vai vairāku ūdeņraža saišu pazušana; 2) reducētas hidrofobās mijiedarbības; 3) apslēpts lādēts atlikums; 4) over-packing (nobriedis proteīns ir pārāk cieši sapakots); 5) elektrostatiskā atgrūšana; 6) apslēpts polārs atlikums; 7) disulfīdsaišu zudums; 8) proteīna molekulas mugurkaula deformācija (ietekmē stabilitāti par 19%) un citi iemesli.
II Ligandu piesaistīšanos ikviens iepriekšminētais nosacījums, kur ligands saistās ar izmainītu sānu grupu.
III Katalīzi ja mainītie aminoskābju atlikumi ir tieši iesaistīti katalītiskos procesos.
IV Allostērisko regulāciju ja regulācijā ir iesaistīti izmainītie aminoskābju atlikumi.
V Pēctranslācijas modifikācijas izjaucot N glikolizilēšanai nepieciešamo N-X-S/T motīvu. [15]
Zinot indivīda SNP genotipu, ir
iespējams prognozēt slimības un izvēlēties optimālu terapiju. Mūsdienās
ir pieejami apmēram miljons marķieru, ar kuru palīdzību var pētīt
genotipa fenotipa korelācijas. [16]

PCR (polimerase chain reaction) jeb polimerāzes ķēdes reakcija ir ļoti populāra molekulārās bioloģijas metode, ar kuras palīdzību no dažiem pikogramiem DNS dažu stundu laikā var iegūt daudz lielāku daudzumu nepieciešamā fragmenta, un šo fragmentu var lietot tālākām analīzēm. PCR pazīstama jau gandrīz 20 gadus (K. Mullis to ieviesa 1985. gadā).
Reakcijas princips ir vienkāršs. Ķīmiski tiek uzsintezēti divi salīdzinoši īsi oligonukleotīdi (15-35 bp), kuri ir komplementāri pavairojamā fragmenta abiem galiem. Šos oligonukleotīdus sauc par praimeriem. Praimeri hibridizējas ar komplementārajām DNS sekvencēm uz pretējiem dubultspirāles pavedieniem, tādējādi atzīmējot pavairojamā fragmenta robežas. Praimeru nukleotīdu sekvencei ir jābūt unikālai, tā lai praimeri nesaistītos nevienā citā DNS vietā. Praimeru šķīdumu sajauc ar DNS paraugu, enzīmu, brīviem nukleotīdiem un reakcijas buferi. Reakcijas katrs cikls sastāv no 3 soļiem:
I DNS denaturēšana. Abi DNS pavedieni atdalās viens no otra, tas notiek apmēram 940 C līdz 950 C temperatūrā. Šajā temperatūrā noārdās ūdeņraža saites starp slāpekļa bāzēm, kas tur kopā abus DNS pavedienus un veido dubultspirāli. Šī soļa ilgums ir 15 60 sekundes.
II Praimeru piesaistīšanās pie DNS pavediena. Šajā solī reakcijas maisījums tiek atdzesēts līdz aptuveni 40 - 720 C. Praimeru saistīšanās temperatūra ir atkarīga no praimera nukleotīdu skaita un sastāva. Tā kā DNS ir denaturēta, praimeriem nav grūti piesaistīties.
III DNS sintēze. Parasti reakcijas maisījums tiek sakarsēts līdz 720 C. Uzskata, ka tieši pie šādas temperatūras ir vislielākā enzīma Taq polimerāzes aktivitāte. Polimerāze pagarina praimeru 3galus, polimerizējot brīvos nukleotīdus komplementāri matricas DNS nukleotīdu secībai. Rezultātā iegūst dubultpavedienu, ko denaturē nākošā cikla I solī. DNS sintēzes ilgums atkarīgs no pavairojamā DNS fragmenta garuma un sintēzes ātruma. Savukārt Taq polimerāzes aktivitāte sintēzes ātrums atkarīga no reakcijā izmantotā bufera, vides pH, sāļu koncentrācijas un arī matricas DNS struktūras.
Šos soļus atkārto apmēram 25 40 reizes. Katrā nākamajā ciklā praimeri var saistīties ne tikai ar matricas DNS, bet arī ar iepriekšējos ciklos uzsintezēto DNS. Tādējādi produkta daudzums pieaug eksponenciāli. Ja ciklu atkārto pārāk maz reižu, tad produkts nav pietiekamā daudzumā, bet atkārtot pārāk daudz reizes nav jēgas, jo tad jau izbeidzas brīvie nukleotīdi un praimeri, samazinās enzīma aktivitāte.
Taq polimerāzi izolē no baktērijas Thermus
aquaticus. Šī ir termofīla baktērija, kas
dzīvo apmēram 70 750 C.
Polimerāze var būt aktīva temperatūrā no 70 - 800 C. Augstākā temperatūrā (virs 900 C) tā zaudē aktivitāti, bet nedenaturējas un
temperatūrai samazinoties tā atkal atgūst savu aktivitāti.

PCR-SSCP (single-strand conformation polymorphism) analīze ir ļoti jūtīga metode nelielu, arī punktveida, mutāciju detektēšanai. PCR produkts tiek denaturēts un sadalīts poliakrilamīda (PAA) gelā. Parauga elekroforētiskais kustīgums ir atkarīgs gan no DNS fragmenta garuma, gan izveidotās telpiskās struktūras formas. Nedenaturējošos apstākļos vienpavediena DNS ieņem īpašu konformāciju, ko nosaka iekšmolekulārās mijiedarbības. Šīs mijiedarbības ir atkarīgas no nukleotīdu sekvences DNS fragmentā. Ja DNS fragmentā notikušas kādas izmaiņas (mutācija), nukleotīdu secība ir izmainīta un līdz ar to arī vienpavediena DNS telpiskā struktūra un izmēri būs savādāki. SSCP analīzē mutēto sekvenci detektē kā DNS fragmenta (zonas) elektroforētiskā kustīguma izmaiņas PAA gelā. SSCP analīze ir ļoti jūtīga metode, ar to var detektēt pat viena nukleotīda nomaiņu vairāku simtu bāzu pāru garā fragmentā. PCR-SSCP analīzes metode ir jūtīga arī uz Thermus aquaticus (Taq) DNS polimerāzes kļūdām sintēzes procesā. Tā kā šīs kļūdas tiek pieļautas dažādās vietās, tad tām nav lielas nozīmes, ja PCR sākumā genomiskā DNS koncentrācija ir vismaz 104 molekulas uz reakciju. Ja lieto mazāku daudzumu molekulu, tad kļūdas, kas notikušas sākuma ciklos var būt nozīmīgas, tāpēc rezultāti jāpārbauda ar vēl vienu neatkarīgu PCR reakciju. {8} SSCP metode ir visjūtīgākā, ja fragments ir 100 300 bp garš, bet ja fragmenta garums ir 300 450 bp, tad metodes jutība samazinās. {10} Fragmentus, kuru garums pārsniedz 400 bp pirms analīzes ar SSCP metodi vēlams sašķelt ar restrikcijas endonukleāzēm. {8}
Vienpavediena DNS molekulas telpiskā konformācija ir atkarīga no fizikālajiem apstākļiem, piemēram, temperatūras, jonu koncentrācijas un šķīdinātāja koncentrācijas. Temperatūras svārstības elektroforēzes laikā ir īpaši nevēlamas, svarīgi, lai dažādās gela vietās būtu vienāda temperatūra, tādēļ nozīmīgi samazināt strāvas radīto gela silšanu un pielietot dzesēšanu. Ir vairāki paņēmieni dzesēšana ar gaisu, gelam vienā pusē var pielikt alumīnija plāksni, var lietot plānus gelus. {8}Temperatūru gelā var izlīdzināt ļaujot cirkulēt un sajaukties augšējās un apakšējās kameras buferiem {13}. Vienpavediena DNS, atkarībā no tās telpiskās struktūras izmēriem, labāk sadalās gelā ar zemu šķērsaistību. Šķērsaistības pakāpi izsaka ar C% (N,N-metilēnbisakrilamīda procentuālā attiecība pret kopējo akrilamīda daudzumu). Gels ar C=5 % ir viscietākais un ar vismazāko poru izmēru. Pie zemāka C% gels ir mīkstāks un ar lielākām porām, tādam gelam ir lielāks jutīgums pret konformācijas izmaiņām. Visbiežāk lieto gelus ar C no 1 līdz 2% un 5 līdz 6%. Ir empīriski noskaidrots, ka glicerīns (5-10%) uzlabo parauga sadalīšanos zonās. Iespējams, ka tas ir tāpēc, ka glicerīnam ir vājas denaturējošas īpašības un tiek atvērtas sīkas struktūras un molekulas virsma kļūst lielāka. Glicerīns arī samazina DNS elektroforētisko kustīgumu, iespējams, ka viskozitātes dēļ, īpaši tad, ja elekroforēze notiek 40C. Domājams, ka arī citi vāji denaturējoši aģenti dod līdzīgu efektu. Dažkārt viens paraugs sadalās vairāk kā divās zonās, kaut arī sekvence ir viena un tā pati. Tas izskaidrojams ar to, ka vienai sekvencei mēdz būt vairākas stabilas konformācijas. Parasti dažādo zonu intensitāte var nebūt vienāda, bet intensitāšu attiecības dažādiem paraugiem ir vienādas. Gadās novērot smērējumus. Tas izskaidrojams ar to, ka izmantotajos apstākļos pavediens ir pārejas stāvoklī starp divām (vai vairākām) konformācijām un pat ļoti nelielas apstākļu izmaiņas (piemēram, temperatūra tuvāk stiklam un gela vidū) izraisa konformācijas izmaiņas. {8}
Lai SSCP analīzē vizualizētu zonas, PCR lieto praimerus vai dezoksinukleotīdus, kuri iezīmēti ar radioaktīviem izotopiem vai fluorescentām krāsvielām. (8)
DNS zonas SSCP analīzē var redzēt arī pēc krāsošanas ar sudraba metodi. (9, 11)
Lai ar SSCP palīdzību atklātu visas
mutācijas, jāveic elektroforēze vairākos apstākļos. SSCP 4 dažādos
apstākļos atklāj 100% mutāciju (10).
