PCR reakcijas produkts ne vienmēr ir pietiekoši daudz un ne vienmēr tas ir specifisks. PCR iznākumu un specifiskumu var uzlabot reakcijas apstākļus. To dara mainot kāda reaģenta koncentrāciju vai arī mainot kāda reakcijas cikla temperatūru.
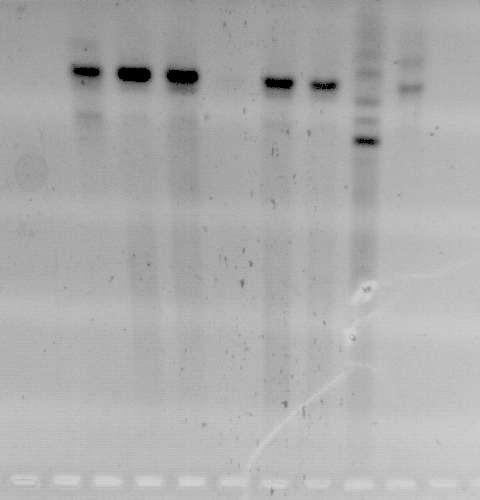
Lai padarītu PCR produktu specifiskāku, firma MBI Fermentas iesaka parastā PCR bufera vietā var lietot buferi ar amonija sulfātu. Diemžēl, izmēģinot šo buferi, rezultāti neuzlabojās (3. attēls), tāpēc turpmāk tas vairs netika lietots.

3. attēls.
Svarīgs PCR reaģents ir magnija hlorīds, kura koncentrācija nosaka magnija jonu daudzumu reakcijas maisījumā. Magnija koncentrācija var ietekmēt: praimera saistīšanos, DNS pavedienu disociācijas temperatūru (gan paaugstināt, gan pazemināt), produkta specifiskumu un praimera formāciju dimēru veidošanos, kā arī enzīmu aktivitāti. Magnija koncentrācijas mainīšanai ir liela nozīme. Taq polimerāzei, saistoties ar DNS pavedienu, praimeri un dNTP, ir nepieciešamas trīs magnija molekulas. Teorētiski magnija koncentrācijai vajadzētu būt par 0,5 līdz 2,5 mM lielākai nekā dNTP koncentrācija. [14]
Lai optimizētu PCR reakciju, tika lietotas trīs dažādas magnija hlorīda koncentrācijas 1, 2 un 3 mM. Kad MgCl2 koncentrācija bija 1 mM, tad produkts sanāca loti vājš, bet pie koncentrācijas 3 mM, produkts bija nespecifisks. Vislabākais produkts sanāca pie koncentrācijas 2 mM (4. attēls), tāpēc turpmāk reakcijā tika izmantota tieši šī MgCl2 koncentrācija.
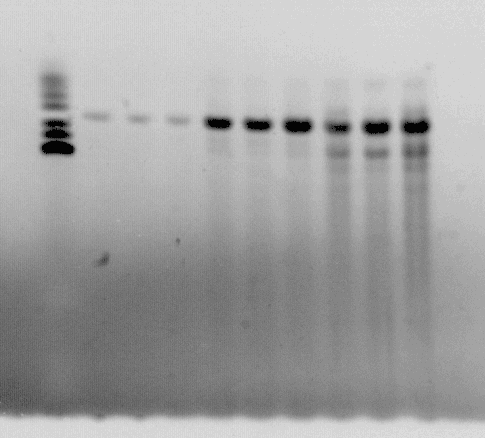
4. attēls.
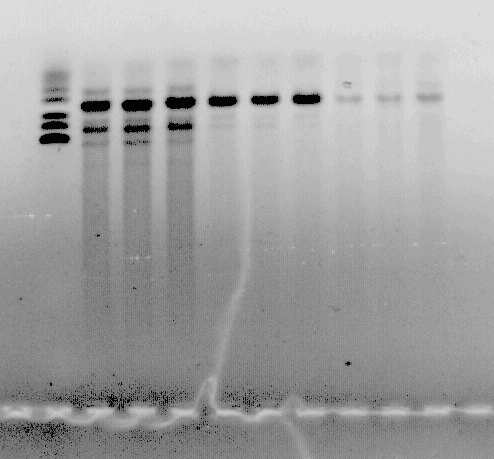
Arī praimeru saistīšanās temperatūra tika mainīta. Sākotnēji tika izvēlēta zemāka temperatūra un pēc tam tā tika paaugstināta. Pie zemākas temperatūras PCR produkts ir nespecifisks, bet, pārāk daudz paaugstinot temperatūru, samazinās produkta daudzums. 5. attēlā redzami PCR rezultāti pie 52, 55 un 570 C. Tika izmēģinātas arī citas temperatūras. Eksperimetu rezultātā par vispiemērotāko temperatūru tika atzīti 550 C, un šī temperatūra tika lietota turpmākajās reakcijās.
Dažādu PAAG sudraba krāsošanas metožu salīdzināšana
Ne vienmēr krāsojot ar sudrabu iegūst vēlamo rezultātu. Pat nelielas izmaiņas atīstītāja sastāvā var stipri izmainīt rezultātu. Šī iemesla dēļ, optimizējot krāsošanas metodi, tika izmēģināti vairāki attīstītāji. Optimizēšana tika veikta ar Mightly small II elektroforēzes iekārtā izdzītiem geliem. Krāsojot mazo gelu, attīstītāju jāmaina vizmaz 3x. Tika izmēģināti četri attīstītāju veidi a, b, c un d:
b) 70 mM Na2CO3; 0,044% formalīns
c) 200 mM NaOH; 0,055% formalīns
d) Attīstīšanu sāk ar pirmo šķīdumu, bet pēc tam turpina ar otro šķīdumu
Pirmais šķīdums: 375 mM NaOH; 0,01% formalīns
Otrais šķīdums: 91 mM Na2CO3
Vislabākā fona/zonu attiecība tika iegūta ar attīstītāju c (attēls), tāpēc turpmāk tika lietots šāds attīstītājs. Žāvēšana mazajiem geliem ir savādāka nekā lielajiem geliem mazos gelus pirms žāvēšanas ieslēdz celofānā, tāpēc pirms žāvēšanas gels vismaz 30 min ir jāmērcē žāvēšanas šķidrumā.
Tā kā lielais gels ir plānāks un tā izmēri ir
lielāki, tad lielā gela attīstītājs tika vēl nedaudz izmainīts. Lielajam
gelam lieto divus attīstītājus vispirms gelu iemērc pirmajā šķīdumā
(200 mM NaOH; 0,055% formalīns) un pēc tam otrajā šķīdumā(100 mM NaOH;
0,055% formalīns).

Pavisam tika analizēti 45 paraugi. Katra parauga DNS sadalās vairākās zonās zonas novietotas dažādos līmeņos. Tika novēroti daži zonu izkārtojuma modeļi, kas atkārtojās daudziem paraugiem, tādēļ zonas iespējams numurēt un tas atvieglo dažādu zonu modeļu noteikšanu. Zonas atšķiras ne tikai pēc novietojuma, bet arī pēc intensitātes. Var gadīties, ka zonas ļoti vājas tāpēc, ka paraugs ir uznests neveiksmīgi, paraugā ir pārāk maza DNS koncentrācija vai arī kāds gela rajons nav labi nokrāsojies. Šo iemeslu dēļ, salīdzinot zonu intensitāti, jāņem vērā ne tikai SSCP raksturīgās zonas, bet arī zona, ko veido DNS dubultspirāles ja šī zona ir vāja, tad arī SSCP zonas šim paraugam ir vājākas un var pat gadīties, ka kādu ļoti vāju zonu ir grūti pamanīt. Pavisam varēja izšķirt 8 dažādus zonu izvietojuma modeļus (7. attēls), bet dominēja 5 zonu veidi. Daži zonu ievietojuma modeļi gelā sastopami tikai vienu reizi. Lai būtu droši, ka paraugi tiešām ir pareizi sadalīti pa grupām, eksperiments tika atkārtots divas reizes. Otrajā reizē paraugi tika uznesti citādā secībā tā, lai vienādie atrastos viens otram blakus. Tādējādi ir vieglāk salīdzināt paraugus. Atkārtotajā eksperimentā visiem paraugiem tika iegūts nedaudz savādāks zonu modelis, bet izdalītās atšķirīgās zonu izvietojuma modeļu grupas saglabājās kā pirmajā eksperimentā. Tas, ka zonu modelis vienam un tam pašam paraugam divos eksperimentos atšķiras, viegli izskaidrojams, ar to, ka abos eksperimentos nedaudz atšķiras apstākļi, piemēram, gaisa temperatūra telpā. Ja vēlas analizēt lielu daudzumu paraugu, tad katrā nākošajā gelelektroforēzē kopā ar analizējamiem paraugiem ir jāuznes arī tādi paraugi, par kuriem jau ir zināms, pie kādas grupas tie pieder, un salīdzinot ar šiem paraugiem var noteikt pie kuras grupas pieder pārējie paraugi.
Pēc iegūtajiem zonu modeļiem paraugi tika sagrupēti piecās grupās: I grupā 23 paraugi, II 3, III 2, IV 4 un V 3. ()Tomēr 9 paraugus nevarēja droši pieskaitīt nevienai grupai. 4 no šiem 9 paraugiem tika nosacīti pieskaitīti I grupai. IV un V grupai katrai tika nosacīti pieskaitīts 1 paraugs. 3 paraugi bija pilnīgi atšķirīgi un tos nevarēja pieskaitīt nevienai grupai, tie arī turpmāk tika analizēti atsevišķi VI, VII un VIII grupa. Salīdzinot diabētisko komplikāciju biežumu un veidu starp dažādām grupām, tika novērotas nelielas atšķirības. Veicot šo pētījumu, protams, tika ņemts vērā arī laika periods, cik ilgi pacients jau slimo ar diabētu.
Salīdzinot vecumus, kuros pacienti saslimst ar diabētu, nekādas lielas atšķirības starp grupām netika novērotas. Lielākajai daļai pētīto pacientu bija proliferatīvais retinopātijas tips. Tikai 5 pacientiem bija novērojama fona retinopātija (šie pacienti pieder pie I (2 pacienti) un II, VI un VII grupas). Diemžēl 1 pacientam retinopātijas tips nebija zināms, bet par 5 pacientiem vispār nebija zināms vai ir retinopātija vai nav. IV grupas pacientiem retinopātija nebija raksturīga, izņemot vienu, kurš pie šīs grupas pieskaitīts tikai nosacīti. Savukārt V grupas pacientiem visiem, izņemot vienu, kurš slimo ar diabētu tikai 1 gadu, bija proliferatīvā retinopātija.
Diabētiķiem sastopamas arī dažādas mikro- un makroangiopātijas. Šīs komplikācijas bieži parādās jau dažos pirmajos slimības gados. Nekāda veida angiopātijas nav tikai 7 pacientiem. Par septiņiem pacientiem diemžēl nav informācijas vai viņiem ir vai nav angiopātija. Ir iespējams, ka pacientam ir tikai mikroangiopātija vai arī tikai makroangiopātija, bet tomēr visbiežāk ir gan viena, gan otra. Tikai makroangiopātija sastopama tikai I grupas pacientiem, savukārt tikai mikroangiopātija sastopama I grupas pacientiem un arī pacientiem no II, IV, VII un VIII grupas (no katras grupas vienam pacientam ).
Ņemot vērā, ka visvairāk pacientu ir tieši pirmajā grupā, varētu pieņemt, ka tas ir normālais (savvaļas) tips (27 pacienti) un pārējie ir ar mutācijām (17). Salīdzinot vidējo vecumu, kādā pacientam diagnosticēts diabēts, starp savvaļas tipam un mutāciju tipam piederošajiem pacientiem, nekādas lielas atšķirības nav pamanāmas. Retinopātijas biežums un veids šīm abām grupām praktiski neatšķiras. Attiecībā un mikro- un makroangiopātiju gan vērojamas nelielas atšķirības. Pacientu daudzums, kuriem ir tikai mikroangiopātija, abiem tipiem praktiski neatšķiras. Tipam ar mutācijām makroangiopātija raksturīga tikai kombinācijā ar mikroangiopātiju, bet mikroangiopātija mēdz būt gan viena pati, gan kombinācijā ar makroangiopātiju. Tākā savvaļas tips ir tā pati I grupa, tad šiem pacientiem gan mikro-, gan makroangiopātija mēdz būt viena pati, gan arī abas kopā.
Kopumā iegūtie rezultāti ir vairāk aprakstoši, jo pagaidām analizētā slimnieku grupa ir samērā neliela.
Šo eksperimentu
rezultātā ir optimizēta PRKCB1 gēna fragmenta (pie 17. eksona)
amplifikācija un tālākā PCR fragmentu analīze ar SSCP metodi. Iegūtie
SSCP rezultāti parāda, ka tiešām ar šo metodi iespējams novērot
atšķirības starp analizējamiem paraugiem SSCP zonu novietojuma modeļi
atšķiras. Tas liecina, ka analizētajā DNS fragmentā atrodas SNP.
Tālākais uzdevums būtu veikt katras no izdalītajām astoņām grupām dažu
pārstāvju PCR produktu analīzi ar sekvenēšanas palīdzību, kas
apstiprinātu vai noliegtu SNP esamību un sniegtu tālāko informāciju par atklāto SNP veidu un iespējamo ietekmi uz
PRKCB1 gēna funkcijām.
