Kodolu magnētiskā rezonanse (nulear
magnetic rezonance, NMR) ir fizikāla parādība, ko rada atoma kodola
magnētiskās īpašības – kodola spina leņķiskais moments. Tikai dažiem
atomu kodoliem (1H, 13C,
15N, 19F un 31P)
šīs īpašības ir tādas, kas dara iespējamu NMR izmantošanu.
Kodola spins izraisa magnētiskā dipola veidošanos. Pakļaujot šķīdumu ar viena veida makromolekulām spēcīgam magnētiskajam laukam, magnētiskie dipoli novietojas vienā no divām orientācijam: paralēli (ar zemu enerģiju) vai antiparalēli (ar augstu enerģiju). Magnētiskie kodoli konkrēta stipruma magnētiskajā laukā spēj absorbēt noteikta stipruma radioviļņus, pie kam dažādi kodoli absorbē dažādas frekvences. Kad notiek šī absorbcija, saka, ka kodols nonāk rezonansē. Pievadot elektromagnētisko starojumu rezonējošā frekvencē un vajadzīgajā leņķī, kodoli absorbē daļu pievadītās enerģijas un pāriet augstās enerģijas stāvoklī. No iegūtā NMR absorbcijas spektra var izdarīt secinājumus par kodolu un ķīmisko vidi ap to.
NMR eksperimentos īpaši svarīgs ir dabā plaši izplatītais 1H. Tomēr pat mazākie proteīni satur vairākus simtus 1H atomu, un iegūtie NMR spektri analīzei ir ārkārtīgi sarežģīti. Praktiski iespējama proteīnu struktūras analīze kļuva iespējama, pateicoties divdimensiju NMR metodēm. Ar tām var noteikt kodolu spinu sasaisti telpā blakus esošajiem atomiem (nuclear Overhauser effect spectroscopy, NOESY) vai kodolu spinu sasaisti ar kovalentu saiti saistītiem atomiem (total correlation spectroscopy, TOCSY).
Izmantojot NOESY un TOCSY iegūtos datus, kā arī atomu optiskās īpašības, to van der Vālsa rādiusus, ķīmisko saišu garumus un leņķus un citus pieejamos datus, īpašas šim mērķim paredzētas datorprogrammas spēj izskaitļot proteīna telpisko struktūru ar augstu izšķiršanas spēju.

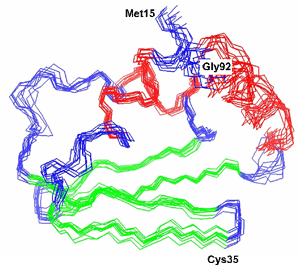
NMR spektroskopijas lielākā priekšrocība ir tā, ka makromolekulas var tikt pētītas dinamiski – šķīdumā. Tas ir svarīgi, jo tādējādi var iegūt proteīna dabiskās konformācijas struktūru, kā arī pētīt dinamiskas tās izmaiņas. Turpretī, proteīnus kristalizējot, tie ir „sastinguši” un var ieņemt kādu citu, „nedabīgu” konformāciju. NMR trūkums ir tas, ka ar to var noteikt tikai nelielu proteīnu (mazāku par 25 kDa) struktūru, tomēr tehnoloģiskie sasniegumi šo robežu pabīda arvien tālāk.
Kodola spins izraisa magnētiskā dipola veidošanos. Pakļaujot šķīdumu ar viena veida makromolekulām spēcīgam magnētiskajam laukam, magnētiskie dipoli novietojas vienā no divām orientācijam: paralēli (ar zemu enerģiju) vai antiparalēli (ar augstu enerģiju). Magnētiskie kodoli konkrēta stipruma magnētiskajā laukā spēj absorbēt noteikta stipruma radioviļņus, pie kam dažādi kodoli absorbē dažādas frekvences. Kad notiek šī absorbcija, saka, ka kodols nonāk rezonansē. Pievadot elektromagnētisko starojumu rezonējošā frekvencē un vajadzīgajā leņķī, kodoli absorbē daļu pievadītās enerģijas un pāriet augstās enerģijas stāvoklī. No iegūtā NMR absorbcijas spektra var izdarīt secinājumus par kodolu un ķīmisko vidi ap to.
NMR eksperimentos īpaši svarīgs ir dabā plaši izplatītais 1H. Tomēr pat mazākie proteīni satur vairākus simtus 1H atomu, un iegūtie NMR spektri analīzei ir ārkārtīgi sarežģīti. Praktiski iespējama proteīnu struktūras analīze kļuva iespējama, pateicoties divdimensiju NMR metodēm. Ar tām var noteikt kodolu spinu sasaisti telpā blakus esošajiem atomiem (nuclear Overhauser effect spectroscopy, NOESY) vai kodolu spinu sasaisti ar kovalentu saiti saistītiem atomiem (total correlation spectroscopy, TOCSY).
Izmantojot NOESY un TOCSY iegūtos datus, kā arī atomu optiskās īpašības, to van der Vālsa rādiusus, ķīmisko saišu garumus un leņķus un citus pieejamos datus, īpašas šim mērķim paredzētas datorprogrammas spēj izskaitļot proteīna telpisko struktūru ar augstu izšķiršanas spēju.


NMR spektroskopijas lielākā priekšrocība ir tā, ka makromolekulas var tikt pētītas dinamiski – šķīdumā. Tas ir svarīgi, jo tādējādi var iegūt proteīna dabiskās konformācijas struktūru, kā arī pētīt dinamiskas tās izmaiņas. Turpretī, proteīnus kristalizējot, tie ir „sastinguši” un var ieņemt kādu citu, „nedabīgu” konformāciju. NMR trūkums ir tas, ka ar to var noteikt tikai nelielu proteīnu (mazāku par 25 kDa) struktūru, tomēr tehnoloģiskie sasniegumi šo robežu pabīda arvien tālāk.