Difrakcija ir viļņu
sajaukšanās un pārklāšanās pēc tam, kad to ceļā ir gadījies šķērslis.
Šī parādība raksturīga visiem viļņu veidiem, tai skaitā, piemēram,
skaņas viļņiem, viļņiem uz ūdens virsmas un elektromagnētiskajiem
viļņiem. Iegūto viļņu sajaukšanās un pārklāšanās attēlu sauc par
difrakcijas ainu. Jāņem vērā, ka kaut kāda difrakcijas aina būs redzama
tikai tad, ja viļņa garums ir samērojams ar tā ceļā esošo objekta
izmēru. Šī izšķiršanas spēja vilnim ir vienāda ar pusi no tā garuma,
tāpēc, lai varētu izšķirt atomu līmeņa detaļas, nepieciešami
rentgenstari, kuru viļņa garums ir 0.07 – 0.15 nm.
Lai varētu izmantot rentgenstaru difrakciju, vispirms jāiegūst proteīna kristāls. Tas izklausās vieglāk nekā parasti ir īstenībā. Bieži vien, lai iegūtu analīzei derīgu kristālu, tas ir noteiktos apstākļos jāaudzē vairākas nedēļas. Praktiski nav iespējams paredzēt, kādi apstākļi (pH, vielu koncentrācijas, temperatūra u.c.) kristalizēšanai būs optimāli, tāpēc bieži vien nākas izmēģināt vairākus variantus, pirms atrod īsto. Iegūtie proteīnu kristāli ir sīki, izmēros parasti mazāki par milimetru, un ļoti trausli. Cilvēki, kas ar šo lietu nodarbojas, jokojoties salīdzina proteīnu kristalizēšanu kā mēģinājumu sastiprināt kopā kaudzi boulinga bumbu ar izolācijas lenti. Pie tam ne visus proteīnus iespējams kristalizēt, un vairāku nozīmīgu proteīnu struktūras nav noteiktas tieši tāpēc, ka ir problēmas ar to kristalizēšanu.
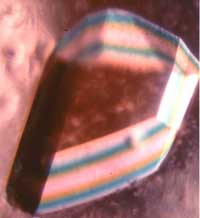
Kad proteīna kristāls veiksmīgi ir iegūts, tas tiek atdzesēts šķidrajā slāpeklī. Tas tiek darīts tāpēc, lai samazinātu rentgenstaru radiācijas radītos bojājumus paraugā, kā arī, lai samazinātu termisko kustību kristālā un mērījumi būtu precīzāki.
Pēc tam caur analizējamo kristālu tiek laists rentgenstaru kūlis ar noteiktu viļņa garumu. Stariem sastopoties ar elektroniem kristālā, notiek to difrakcija. Aiz parauga novietotā rentgenfilma vai attiecīgs detektors uztver radušos difrakcijas ainu, no kuras dators rekonstruē telpisku elektronu blīvuma karti. Tad šajā kartē attiecīgajās vietās ievieto atomus, iegūstot telpisku molekulas modeli.


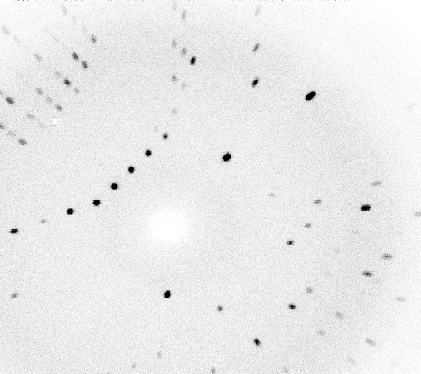
Pirmais proteīns, kam šādā veidā tika noteikta tā kristālu struktūra, bija kašalota mioglobīns. To 1958. gadā paveica Makss Perucs un Džons Kendrjū, par ko vēlāk saņēma Nobela prēmiju ķīmijā. Izrādījās, ka mioglobīna difrakcijas aina ir ļoti komplicēta, ar vairāk nekā 25000 atstarojumiem tajā. Ar tā laika skaitļošanas jaudām tās analīze notika vairākos posmos, ar katru nākamo uzlabojot izšķirtspēju, līdz beidzot 1959. gadā bija noskaidrots faktiski visu neūdeņraža atomu telpiskais novietojums. Dž. Kendrjū žurnālā Nature rakstīja: „Droši vien visievērojamākās mioglobīna iezīmes ir tā sarežģītība un simetrijas trūkums. [Atomu] novietojumam gandrīz pilnībā trūkst regularitātes, kas neapzināti tika gaidīta, un tas ir daudz sarežģītāks, nekā jebkura proteīnu struktūras teorija to bija paredzējusi.” Kopš tā laika ar rentgenstaru difrakcijas metodi ir noteikta struktūra daudziem tūkstošiem proteīnu, daudzi no kuriem ir ievērojami lielāki un sarežģītāki par mioglobīnu.
Rentgenstaru difrakcija ir visbiežāk izmantotā proteīnu struktūras noteikšanas metode – apmēram 90% no visām struktūrām, kas ir Proteīnu datu bankā, ir noteiktas ar šo metodi.
Lai varētu izmantot rentgenstaru difrakciju, vispirms jāiegūst proteīna kristāls. Tas izklausās vieglāk nekā parasti ir īstenībā. Bieži vien, lai iegūtu analīzei derīgu kristālu, tas ir noteiktos apstākļos jāaudzē vairākas nedēļas. Praktiski nav iespējams paredzēt, kādi apstākļi (pH, vielu koncentrācijas, temperatūra u.c.) kristalizēšanai būs optimāli, tāpēc bieži vien nākas izmēģināt vairākus variantus, pirms atrod īsto. Iegūtie proteīnu kristāli ir sīki, izmēros parasti mazāki par milimetru, un ļoti trausli. Cilvēki, kas ar šo lietu nodarbojas, jokojoties salīdzina proteīnu kristalizēšanu kā mēģinājumu sastiprināt kopā kaudzi boulinga bumbu ar izolācijas lenti. Pie tam ne visus proteīnus iespējams kristalizēt, un vairāku nozīmīgu proteīnu struktūras nav noteiktas tieši tāpēc, ka ir problēmas ar to kristalizēšanu.

Kad proteīna kristāls veiksmīgi ir iegūts, tas tiek atdzesēts šķidrajā slāpeklī. Tas tiek darīts tāpēc, lai samazinātu rentgenstaru radiācijas radītos bojājumus paraugā, kā arī, lai samazinātu termisko kustību kristālā un mērījumi būtu precīzāki.
Pēc tam caur analizējamo kristālu tiek laists rentgenstaru kūlis ar noteiktu viļņa garumu. Stariem sastopoties ar elektroniem kristālā, notiek to difrakcija. Aiz parauga novietotā rentgenfilma vai attiecīgs detektors uztver radušos difrakcijas ainu, no kuras dators rekonstruē telpisku elektronu blīvuma karti. Tad šajā kartē attiecīgajās vietās ievieto atomus, iegūstot telpisku molekulas modeli.


Rentgenstaru
difraktometrā ievietots kristāls. Attēls no šejienes.
Pirmais proteīns, kam šādā veidā tika noteikta tā kristālu struktūra, bija kašalota mioglobīns. To 1958. gadā paveica Makss Perucs un Džons Kendrjū, par ko vēlāk saņēma Nobela prēmiju ķīmijā. Izrādījās, ka mioglobīna difrakcijas aina ir ļoti komplicēta, ar vairāk nekā 25000 atstarojumiem tajā. Ar tā laika skaitļošanas jaudām tās analīze notika vairākos posmos, ar katru nākamo uzlabojot izšķirtspēju, līdz beidzot 1959. gadā bija noskaidrots faktiski visu neūdeņraža atomu telpiskais novietojums. Dž. Kendrjū žurnālā Nature rakstīja: „Droši vien visievērojamākās mioglobīna iezīmes ir tā sarežģītība un simetrijas trūkums. [Atomu] novietojumam gandrīz pilnībā trūkst regularitātes, kas neapzināti tika gaidīta, un tas ir daudz sarežģītāks, nekā jebkura proteīnu struktūras teorija to bija paredzējusi.” Kopš tā laika ar rentgenstaru difrakcijas metodi ir noteikta struktūra daudziem tūkstošiem proteīnu, daudzi no kuriem ir ievērojami lielāki un sarežģītāki par mioglobīnu.

Fragments no
mioglobīna difrakcijas ainas. Attēls no Wikipedia.
Rentgenstaru difrakcija ir visbiežāk izmantotā proteīnu struktūras noteikšanas metode – apmēram 90% no visām struktūrām, kas ir Proteīnu datu bankā, ir noteiktas ar šo metodi.