S. aureus sortāze A ir no 206 aminoskābju atlikumiem sastāvošs 23540Da smags proteīns. Proteīna N-galā ir sekrēcijas signāls. Šī signāla dēļ sortāze pēc sintēzes (citoplazmas ribosomās) uzreiz tiek transportēta uz ārpusšūnas telpu, kur tā veic savas funkcijas. Sortāzes B paveida enzīmiem signālsekvence ir C-galā. Enzīmam arī ir tā saucamais "stop-transfer" signāls, kas ļauj proteīna daļai noenkuroties šūnas membrānā. Tādā veidā enzīms paliek saistīts ar šūnu un nedifundē ārējā vidē.
Katalītiskais domēns (proteīna daļa, kura atbild par reakcijas katalīzi) sastāv no 59-206 enzīma aminoskābju atlikumiem, atsevišķi ekspresēts un attīrīts katalītiskais domēns pēc spējas katalizēt traspeptidācijas reakciju ir identisks natīvās formas fermentam (Ilangovan et al. 2001).
|
mkkwtnrlmt iagvvlilva aylfakphid nylhdkdkde kieqydknvk eqaskdnkqq akpqipkdks kvagyieipd adikepvypg patpeqlnrg vsfaeenesl ddqnisiagh tfidrpnyqf tnlkaakkgs mvyfkvgnet rkykmtsird vkptdvevld eqkgkdkqlt litcddynek tgvwekrkif vatevk |
S. aureus (MRSA252 celma) sortāzes A aminoskābju secība. Avots: NCBI datubāze
Kaut gan formāli sortāze pieder pie hidrolāžu (enzīmi, kuri šķeļ saites) grupas, tā darbojas vienlaikus gan kā hidrolāze, gan kā ligāze (enzīms, kurš veido jaunas saites). Tik neparasta darbība padara sortāzi par unikālo fermentu, kuram ir maz analogu dzīvā dabā. Abi procesi ir savstarpēji saistīti un viena saites sagraušana ir nepieciešama otras saites veidošanai, jo hidrolīze kalpo par enerģijas avotu sintēzei.

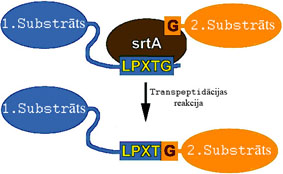
5. Attēls. Sortāzes A katalīzes shēma. Attēla autors: D. Žuļenkovs (© D. Žuļenkovs 2008).
Sortāzes aktīvo centru, veido asparagīns 98, histidīns 120 un cisteīns 184 pozicijā (N98, H120 un C184), kuri atrodas hidrofobā vidē, kas, savukārt, ļauj sortāzes atpazīšanas saitam ienākt aktīvajā centrā. Iespējams, ka H120 imidazola gredzens aktivizē C184 un tā ietekmē veidojas tiolāts, kas, savukārt, nukleofīli uzbrūk C atomam substrāta peptīdsaitē. Pēc šķelšanas veidojas tioacīlferments, kuram nukleofīli var uzbrukt otrā substrāta aminogrupa. Sortāzes darbības mehānisms tādā veidā var atgadināt papaīna/katepsīna enzīmu (proteāzes ar reaktīvo -SH grupu) šķelšanas mehānismu (Ilangovan et al. 2001).
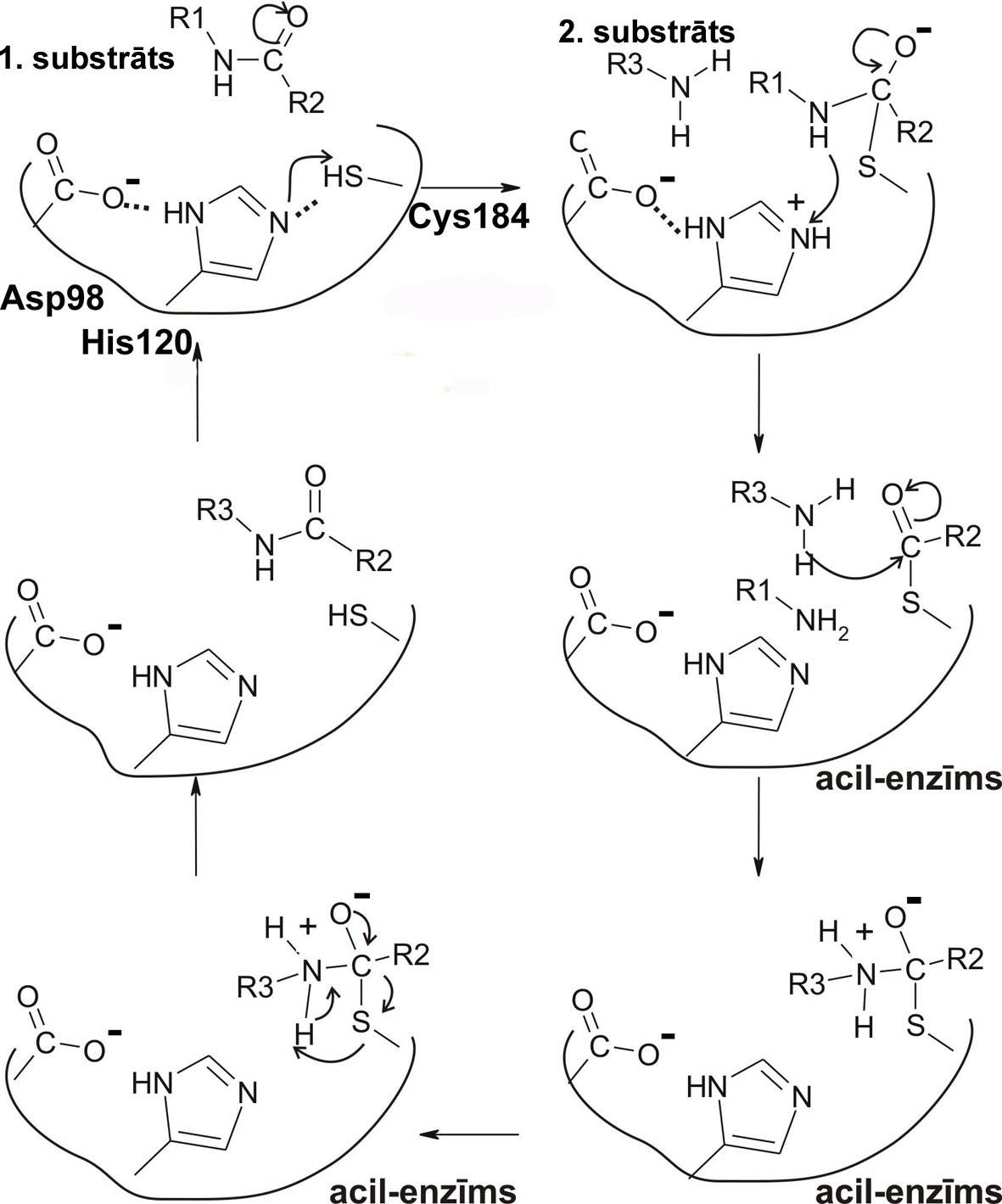
6. Attēls. Iespējamais sortāzes A reakcijas ķīmiskais mehānisms. Tika piedāvāts, izmantojot informāciju no rakstiem par sortāzi A (galvenokārt Ilangovan et al. 2001) un autora zināšanām par tiolhidrolāžu darbības bioķīmiju. Autors neapgalvo, ka dotā shēma atbilst patiesībai. Ar bultiņām parādītas atomu mijedarbības un elektronu kustības saitēs. 1) Asp98 ietekmē (ar His120 starpniecību) Cys184 tiolgrupa disociē, veidojot nikleofīlo tiolātjonu. 2) Tiolātjons uzreiz nikleofīli uzbrūk 1. substrāta (virsmas proteīna) karboksilgrupas C atomam un veido ar to kovalento saiti (veidojas acil-enzīms). Acil-enzīma S-C saitei ir diezgan liela enerģija, kura turpmāk palīdzēs peptīdsaites veidošanai 3) 2. substrāta (piem. šūnas sienas tiltiņa aminoskābes) N atoms aminogrupā nukleofīli uzbrūk acil-enzīmam (2. substrāta vietā var būt arī ūdens molekula, tad mehānisms ir ļoti līdzīgs cisteīna proteāžu mehānismam) un veidojas jauna peptīdsaite. Attēla autors: Dmitrijs Žuļenkovs (© D. Žuļenkovs 2008).
Kā tika minēts augstāk, sortāzes reakcija ir svarīgs virsmas proteīnu pēctranslācijas modifikāciju mehānisma posms. Vairākām Gr+ baktērijām virsmas proteīniem ir milzīga lomā izdzīvošanā un patoģenēzē, tie piedalās dažādos metabolismos, tāpēc sortāze ir perspektīvs mērķis antibiotisko vielu iedarbībai. Tā kā kaitīgas baktērijas, kuram nav iespējas piestiprināt proteīnus pie šūnas sienas ir daudz mazāk dzīvotspējīgas un bīstamas, pat ja dabiski tie ir diezgan izturīgi pret organisma aizsardzības sistēmām. Pētot sortāzes katalīzes mehānismus un procesus, kuros enzīms ir iesaistīts, ir iespējams arī saprast šo mehānismu vājākas vietas, uz kurām, savukārt var iedarboties, cīnoties ar slimību izraisītājiem. Sortāzes ir atrastas vairākos Gr+ baktēriju veidos un to darbības principi ir ļoti līdzīgi, tāpēc arī sortāzes darbības spēcīgie inhibitori var būt universālas antibiotiskās vielas cīņā pret veselu patogēnu klasi gan cilvēkiem, gan dzīvniekiem.
No otras puses, sortāzes, faktiski, veic unikālo proteīnu savienošanas (ligēšanas) reakciju. Ir nedaudz enzīmu, kuri spēj veikt šādas reakcijas. Tā kā sortāzes katalizē reakcijas ļoti specifiski, tās var atrast pielietojumu arī biotehnoloģijā (līdzīgi DNS ligāzēm, kuras tiek plaši izmantotas darbiem ar DNS molekulārās bioloģijas sfērā).
|
© Dmitrijs Žuļenkovs |
Modifikācijas datums un laiks: 20.01.2008 07:10:51 |