Kad transpeptidācija notiek šūnā, citoplazmā ir pieejami universālie enerģijas nesēji – nukleozīdu trifosfāti. Ribosoma, pagarinot proteīnu par vienu aminoskābi tērē divas GTF molekulas, kuras tiek hidrolizētas līdz GDF un fosfātam.
Var rasties jautājums, kāpēc vienas peptīdsaites veidošanai tiek izmantoti divi enerģijas nesēji, un kuros procesos tie tiek patērēti. Zemāk ir dota vienkāršota shēma polipeptīda ķēdes elongācijai ribosomā, kurā ir parādīts, ka viena reakcija sadalās četrās stadijās, no kurām divas prasa GTF enerģiju.
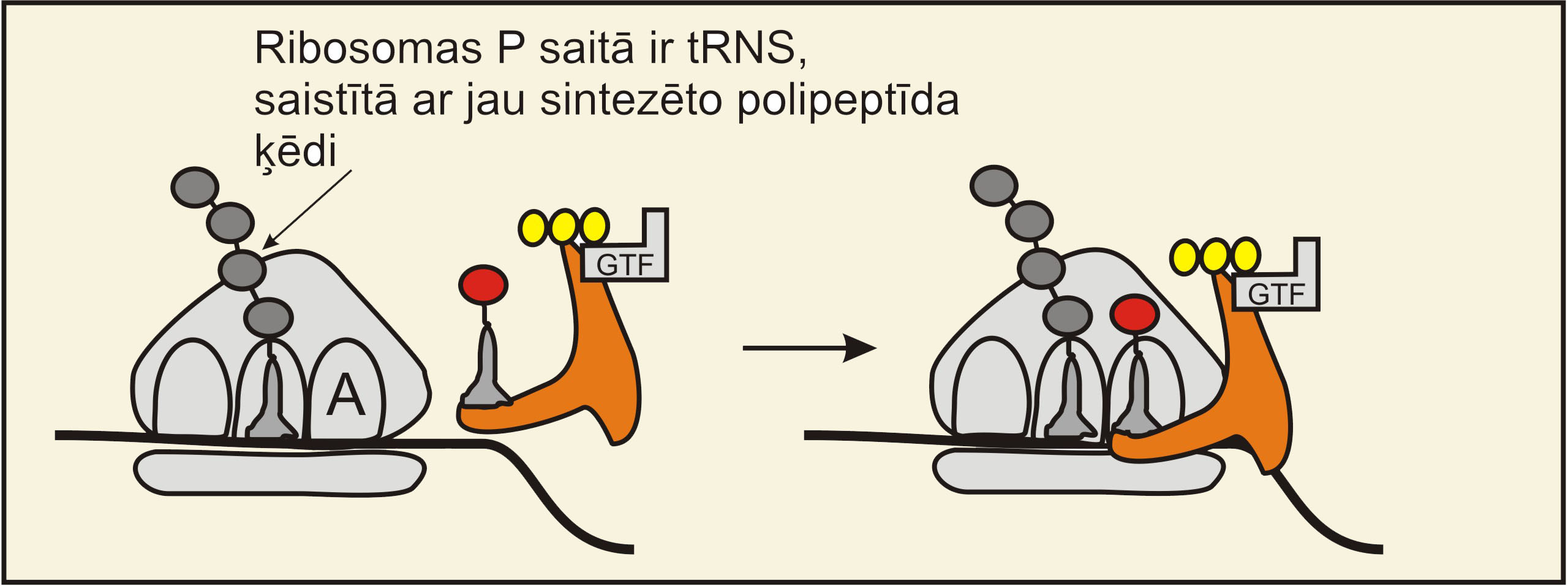
1) Ribosomā P saitā atrodas tRNS molekula, kura ir saistīta ar jau uzsintezēto polipeptīda ķēdi. Jaunas aminoacil-tRNS (kompleksā ar aminoskābi) var ienākt ribosomas A saitā, bet tam ir nepieciešami proteīni-faktori, kuri atvieglo tRNS transportu. ET-Tu proteīns ir viens no tādiem faktoriem. Tas saistās ar aminoacil-tRNS un GTF (enerģijas avots) an atvieglo tRNS ienākšanu A saitā (1. Attēls)

1.Attēls. ET-Tu proteīns, kofaktors,
palīdz jaunai tRNS kompleksā ar aminoskābi ienākt ribosomā. Attēla autors:
Dmitrijs Žuļenkovs (© D. Žuļenkovs 2008)
2) Kad tRNS ir ievietota A saitā, ET-Tu proteīns hidrolizē GTF. Izdalītā enerģija atvieglo proteīna disociāciju no kompleksa. Šī enerģija sekmē arī tRNS disociāciju, tāpēc šajā posmā A saitā var palikt tikai specifiskā tRNS: nespecifiskā tRNS veido vājākas saitēs ar ribosomā esošo mRNS un vieglāk disociē.
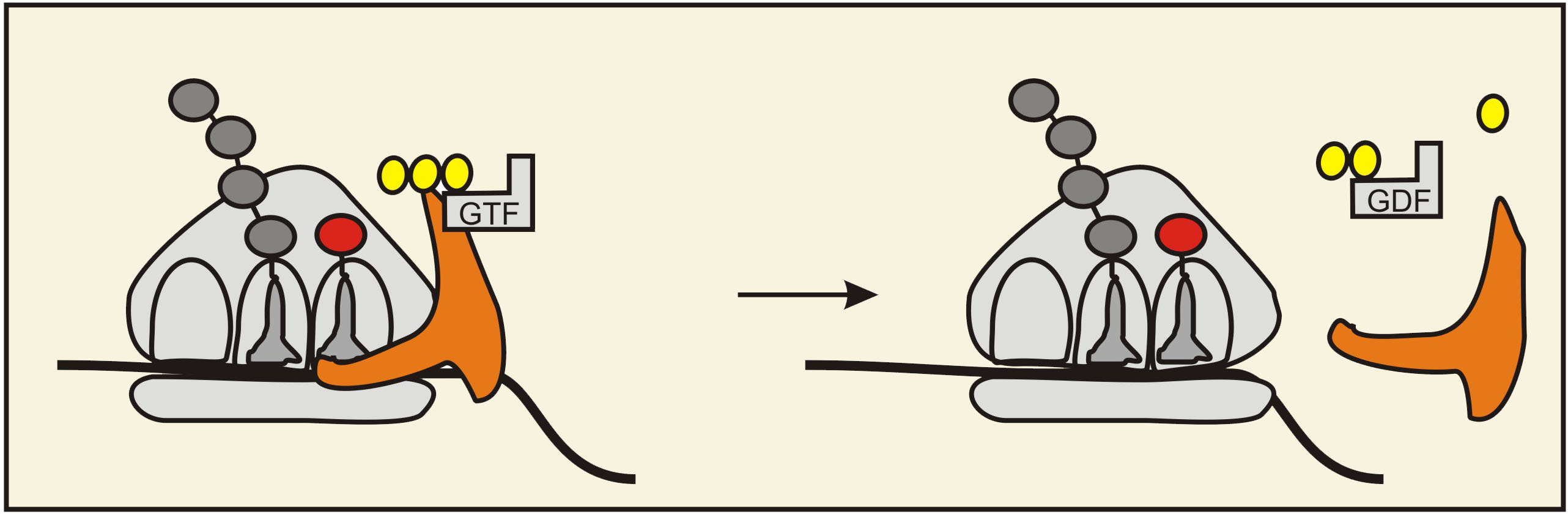
2. Attēls. Kofaktors ET-Tu hidrolizē GTF un disociē no kompleksa. Attēla autors: Dmitrijs Žuļenkovs (© D. Žuļenkovs 2008)
3) Kad aminoacil-tRNS, kura atbilst dotajam antikodonam mRNS molekulā ir ievietota A-saitā, ribosomā ieiet vēl viens translācijas faktors – ET-G proteīns kompleksā ar GTF molekulu. Rezultātā proteīna daļa aizņem vietu A saitā un nobīda lielo subvienību mRNS 3’ gala virzienā. Tā kā abi tRNS kompleksi ribosomā paliek saistīti ar mRNS, to izvietojums saitos arī tiek izmainīts. Procesā āgrāk izveidotā polipeptīdu ķēde tiek pārnesta uz aminoacīl-tRNS kompleksu un veidojas jauna peptīdsaite.
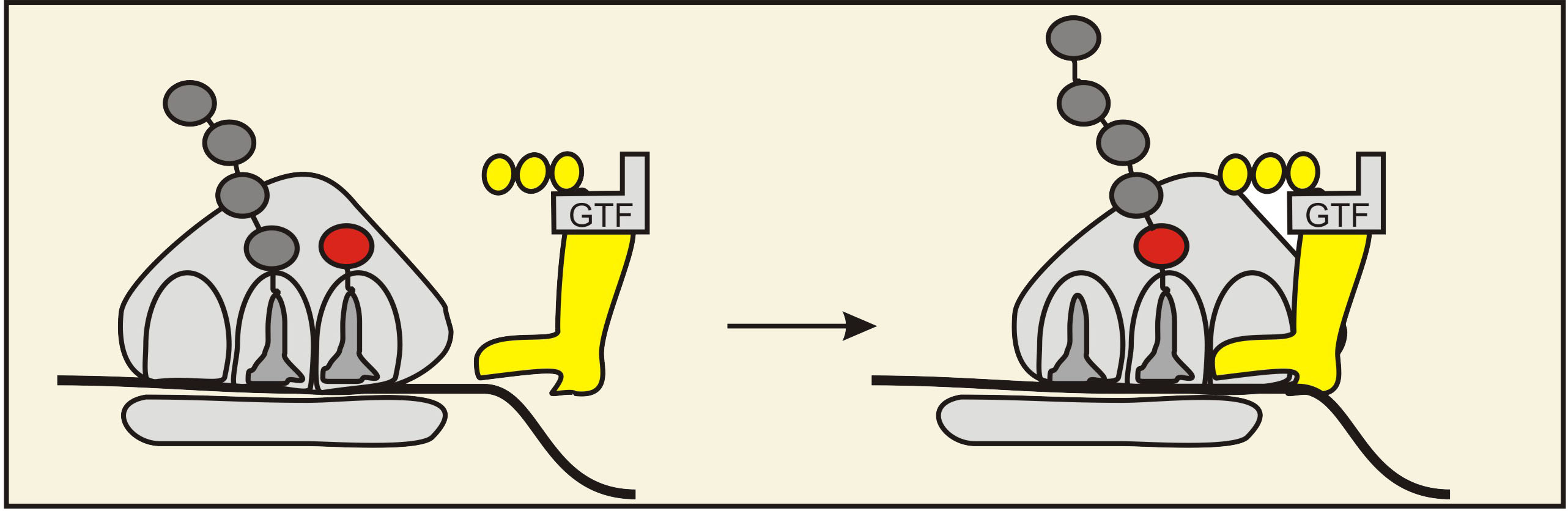
3. Attēls. Kofaktors ET-G nobīda lielo
subvienību mRNS ķēdes 3'-gala virzienā. Rezultātā mainās tRNS kompleksu
izvietojums ribosomā un līdz ar to polipeptīdu ķēde tiek parnesta no vienas tRNS
uz aminoacīl-tRNS. Veidojas jauna peptīdsaite. Attēla autors: Dmitrijs Žuļenkovs
(© D. Žuļenkovs 2008)
4) Kofaktors ET-G hidrolizē GTF un disociē no ribosomas. Procesā mRNS 3'-gala virzienā tiek pārbīdīta arī mazā subvienība. Subvienību relatīvais izvietojums atjaunojas, bet tagad ribosoma atrodas par vienu kodonu (nukleotīdu tripletu) tuvāk mRNS 3'-galam. Brīvā tRNS disociē no E saita. P saitā paliek tRNS kompleksā ar polipeptīdu.
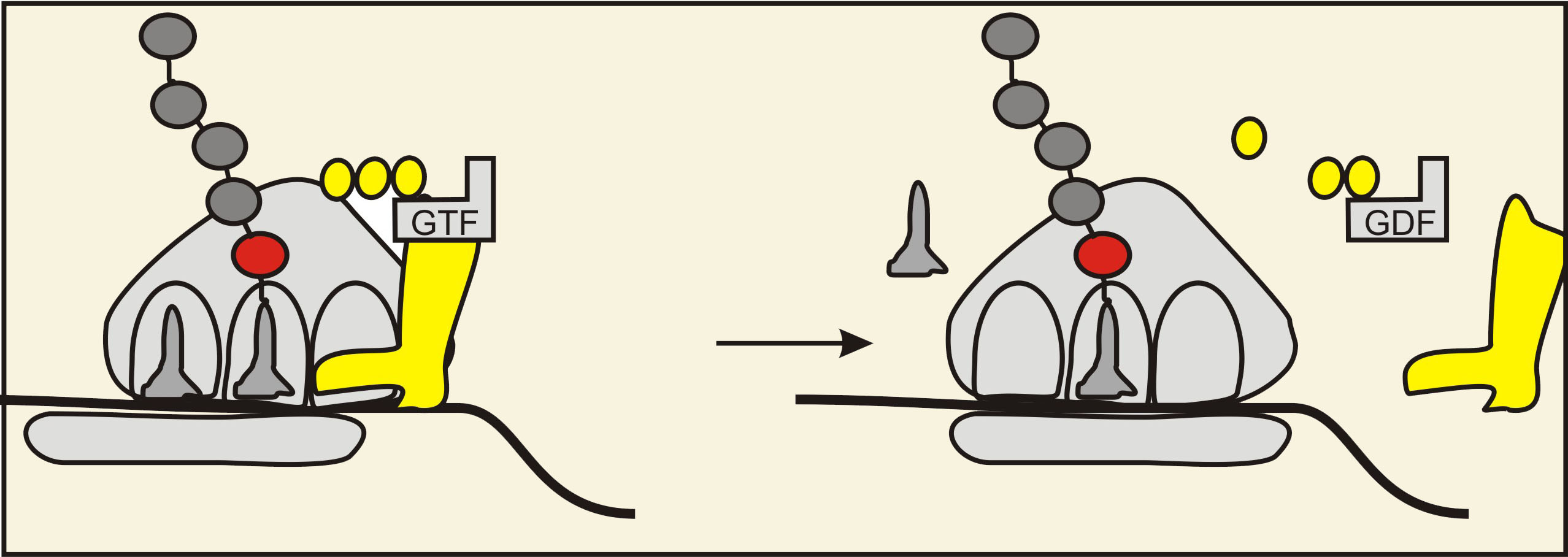
4. Attēls. ET-G kofaktors hidrolizē GTF un ar izdalīto enerģiju pārbīda mazo subvienību, atjaunojot ribosomas konfigurāciju. Faktors un tRNS bez aminoskābes šajā procesā disociē. Attēla autors: Dmitrijs Žuļenkovs (© D. Žuļenkovs 2008)
|
© Dmitrijs Žuļenkovs |
Modifikācijas datums un laiks: 20.01.2008 06:36:11 |