Ogļskābes anhidrāzes katalītiskās reakcijas
mehānisms
Ogļskābes anhidrāze ir enzīms, kas katalīzē
atgriezenisko reakciju:
CO
2+H
2O --> HCO
3- +
H
+
Atgriezeniskā reakcija bez katalizatora ir samērā lēna. Reakciju,
kurā ūdens molekula tiek izšķelta no ogļskābes, veidojot oglekļa
dioksīdu, katalizē ogļskābes anhidrāze, un tieši tā enzīms ir
ieguvis savu nosaukumu (Berg et al., 2002). Šo procesu var novērot
arī gāzētajos dzērienos tā kā reakcijai gāzētā dzēriena pudelē
nav katalizatora, dzēriens tiek atgāzēts samērā lēni, bet
dzērienam mutē saskaroties ar siekalām, reakcija notiek ievērojami
ātrāk, jo siekalu sastāvā ir CA (Thatcher et al., 1998).
CA enzīmu reakcijas ātrums ir robežās starp 104 un 106 reakcijām
sekundē, kas ir viens no lielākajiem starp visiem enzīmiem.
Reakcijas ātrumu ierobežo galvenokārt substrāta difūzijas ātrums
(Lindskog, 1997). Gandrīz visu CA aktīvajos centros ir cinka joni,
kuru dēļ arī CA tiek pieskaitīti pie metālenzīmiem. Divvērtīgais
cinka jons parasti enzīmos tiek saistīts ar četriem vai sešiem
ligandiem. Ogļskābes anhidrāzē tas tiek koordinēts ar trīs
histidīnu imidazola gredzenu slāpekļa atomiem, bet ceturtā
koordinācijas pozīcija tiek aizņemta ar ūdens molekulu. Tas noved
pie ūdeņraža-skābekļa saites polarizācijas, padarot skābekli
mazliet negatīvāku, tādējādi pavājinot saiti (Berg et al., 2002).
Aktīvais centrs satur arī specifisku kabatu oglekļa dioksīdam,
novietojot to tuvu hidroksīda grupai. Tas ļauj hidroksīdam
ietekmēt oglekļa dioksīdu, veidojot bikarbonātu (Krebs et al.,
1993).
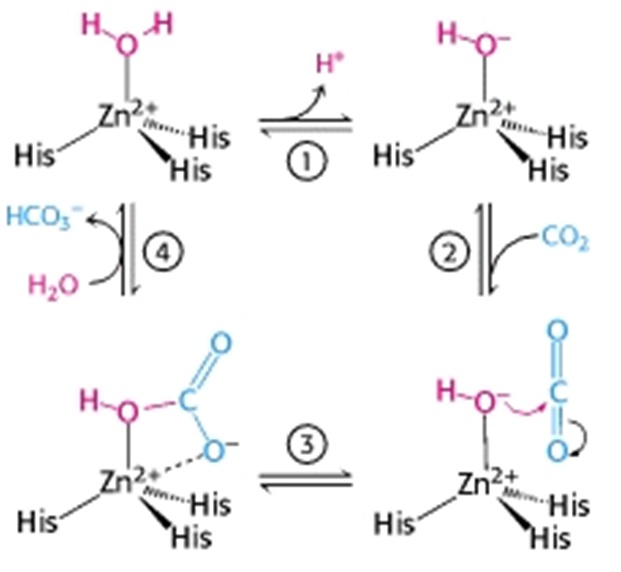
1.attēls. Ogļskābes anhidrāzes aktīvajā centrā
notiekošās katalītiskās reakcijas. 1-Protona atbrīvošana, 2-CO2
piesaiste, 3-bikarbonāta izveide, 4-bikarbonāta atbrīvošanās un
aktīvā centra atjaunošanās (Berg et al., 2002).
Figure 1. Carbonic anhydrase active-site catalytic reactions. 1-
proton release, CO2 release, 3- bicarbonate formation, 4-
bicarbonate release and active site regeneration (Berg et al.,
2002).
1. attēlā redzama ogļskābes anhidrāzes katalītiskā
reakcija un tās aktīvajā centrā esošais Zn2+ jons, kuru koordinē
trīs histidīni un tam piesaistījusies ūdens molekula. Pirmajā
reakcijā notiek protona atbrīvošana no ūdens molekulas, veidojot
hidroksīda jonu. Šo reakciju sekmē aktīvajā centrā esošais cinka
jons. Otrajā reakcijā oglekļa dioksīds piesaistās pie enzīma
aktīvā centra un tiek novietots labvēlīgā orientācijā reakcijai ar
hidroksīda jonu. Trešajā reakcijā hidroksīda jons ietekmē oglekļa
dioksīdu, pārvēršos to par bikarbonātu un anjoniskais skābeklis
izveido saiti ar Zn2+, veidojot gredzenveida struktūru. Ceturtajā
reakcijā bikarbonāts tiek atbrīvots un tiek piesaistīta jauna
ūdens molekula.
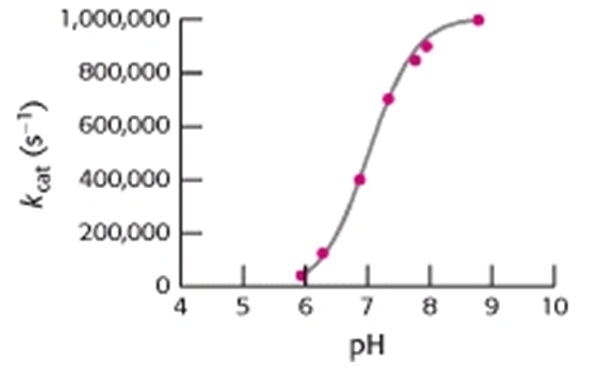
2. attēls. Ogļskābes anhidrāzes II reakcijas
ātrums atkarībā no pH. (Berg et al., 2002).
Figure 2. Carbonic anhydrase II reaction rate depend on pH. (Berg
et al., 2002).
Kā redzams 2. attēlā, ogļskābes anhidrāzes
katalītiskā reakcija notiek visātrāk pie pH virs 8. Tieši tāpēc,
nosakot ogļskābes anhidrāzes aktivitāti, tiek izmantots
buferšķīdums ar pH 8,3 (Berg et al., 2002).
Jānis Leitāns 13.01.2013

