Tu atrodies šeit: Sākums » Audzēju antigēni
Navigācija
- Sākums
- Ļaundabīgo audzēju raksturojums
- Neierobežots proliferācijas potenciāls
- Izvairīšanās no apoptozes
- Spēja metastazēt
- Spēja inducēt angioģenēzi
- Nejutība pret ārējiem augšanu inhibējošiem faktoriem
- Augšanas faktoru pašpietiekamība
- Vēža imūnrediģēšana
- Audzēju antigēni
- Saites
Audzēju antigēni
Atšķirībā no dzīvnieku modeļiem, cilvēka neoplastiskiem audiem specifisku antigēnu eksistence tika nepārprotami demonstrēta tikai 1991. gadā, kad T. Būna (Boon) grupa aprakstīja melanomas antigēnu MAGE-1[1], taču, attīstoties antigēnu identificēšanas metodikai, jau 2002. gadā zināmo audzēja antigēnu skaits pārsniedza 2,5 tūkstošus[2]. Šādas zināšanas par audzēju antigēniem paver jaunas ļaundabīgo audzēju diagnostikas un terapijas iespējas.
Vairums identificēto audzēja antigēnu iespējams klasificēt pēc to ekspresijas rakstura, funkcijām vai izcelsmes, ierindojot tos kādā no sekojošām kategorijām[3][4]:
-
Vēža-sēklinieku (cancer-testis) antigēni antigēni, kuri raksturīgi audzēja šūnām, bet nav sastopami normālos ausos, izņemot sēkliniekus, kas ir imūn-privileģēts rajons. Pie šādiem antigēniem pieskaitāmi MAGE-1, MAGE-2, MAGE-4a, HOM-MEL-40, NY-SO-1 u.c.[5][6]. NY-ESO-1 ir viens no visimunogēnākajiem audzēja antigēniem un izraisa imūno atbildi 40-50% pacientiem ar NY-SO-1+ audzēju[7].
Diferenciācijas antigēni antigēni, kas raksturīgi kādas noteiktas izcelsmes vēža šūnām, kā arī tādas pašas izcelsmes normālām šūnām. Pie šādiem antigēniem var pieskaitīt, piemēram, melanomai raksturīgu antigēnu - tirozināzi, kas sastopama arī normālos melanocītos[8].
Mutantie antigēni antigēni, kas ekspresēti no mutējušiem gēniem. Šādi antigēni sastāda tikai nelielu daļu no visiem zināmajiem audzēju antigēniem[9]. Pie šādiem antigēniem pieskaitāmi MUM-1, p53, CDK4 u.c.[10].
Pārmērīgi ekspresētu gēnu produkti antigēni, kas sastopami gan audzēja šūnās, gan normālās šūnās, taču audzēja šūnās to ekspresijas apjoms var būt daudzkārt palielināts, pārsniedzot kritisko slieksni, virs kura sāk izpausties imūnā atbilde[11]. Pie šīs grupas pieskaitāmi HER2/neu, p53 u.c.[12].
Alternatīvie splaisinga varianti ar audzēju asociēti splaisinga varianti, kam piemīt imunogēna aktivitāte, piemēram, Hodžkina limfomai (Hodgkins lymphoma) raksturīgs antigēns restīns[13].
Ar posttranslācijas modifikācijām saistītie antigēni - Antigēni, kas tiek ekspresēti vienādos apjomos gan audzēja, gan normālos audos, taču imūno atbildi, pateicoties post-translācijas modifikācijām, izraisa vienīgi audzēja pacientiem. Pie šīs grupas pieskaitāms, piemēram, HOM-MEL-2.4[14][15].
Virālie antigēni virālas izcelsmes antigēni, piemēram, HERV-K10 retrovīrusa env proteīns, kas sastopams nieru audzējos[16].
Audzēju antigēnu meklēšanai un identificēšanai ir izstrādātas vairākas metodes:
-
Autologā seroloģiskā antigēnu identificēšana metodi 20.gs. 70. gados attīstīja Loida J. Olda grupa un tā balstās uz autologa seruma antivielu spēju reaģēt ar audzēja antigēniem. Metodē tika izmantotas kultivētas vēža šūnu līnijas un autologs serums, lai veicot izvērstus absorbcijas testus, noteiktu antigēnu-antivielu saistību. Metodes ierobežotais potenciāls ļauj identificēt tikai nelielu daļu audzēju antigēnu[17][18].
Tc šūnu epitopu klonēšana metode attīstīta 20.gs. 90. gadu sākumā un tā balstās uz audzēja kDNS bibliotēkas ieklonēšanu atbilstošu MHC-1 ekspresējošās mērķšūnās un sekojošas uz MHC-1 prezentēto antigēnu epitopu identificēšanas, izmantojot no audzēja infiltrāta izdalītas Tc šūnu līnijas. Šī metode ir ļoti darbietilpīga, jo nepieciešamas Tc šūnu līnijas un iemaņas klonēšanā[19][20].
MHC-1 saistīto peptīdu eluēšana metode baltās uz peptīdu eluēšanu no audzēja šūnām vai attīrītām audzēja MHC-1 molekulām un uznešanas uz APC šūnām, kam seko attiecīgo APC reaktivitātes testi ar Tc šūnām. Ar Tc reaģējošie antigēni tālāk tiek attīrīti un sekvenēti. Šī metode prasa iemaņas proteīnu ķīmijā, proteīnu attīrīšanā, kā arī masspektrometrijā[21].
Diferenciālās ekspresijas analīzes izmanto jaunākos tehnoloģiskos risinājumus, lai atklātu RNS un proteīnus, kas tiek atšķirīgi ekspresēti normālās un audzēja šūnās[22].
SEREX (serological analysis of recombinant cDNA expression libraries) metodi 1995. gadā uz autologās seroloģiskās antigēnu identificēšanas metodes bāzes izstrādāja M. Freundšuhs (Pfreundschuh). Īsi pēc metodes izstrādes tika aizsākta Starptutiskā SEREX Programma (International SEREX Program), kuras ietvaros Vēža Imunoma Datubāze (Cancer Immunome Database), kas ir lielākā publiski pieejamā vēža antigēnu datubāze, papildināta jau par aptuveni 2000 antigēnu sekvencēm[23].
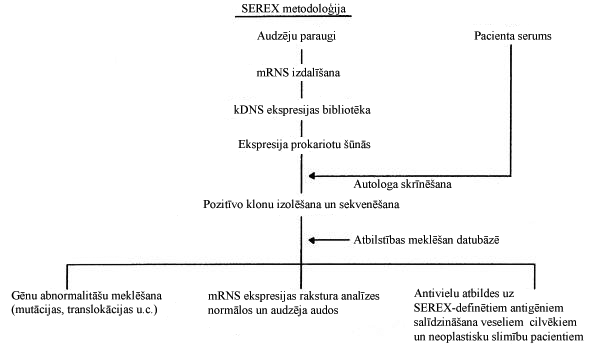
Klasiskajā SEREX metodē (6. attēls) no svaigiem audzēja paraugiem, izmantojot λ-fāga vektoru, tiek konstruēta kDNS bibliotēka un ekspresēta Escherichia coli baktērijā. Rekombinantie λ-fāgi no plakiem tiek pārnesti uz nitrocelulozes membrānas un skrīnēti ar augsta titra IgG antivielām, kas pārstāvētas pacienta serumā. Izmantojot ar enzīmu konjugētas sekundārās antivielas pret cilvēka IgG, kā antigēni tiek identificēti ar seruma IgG reaģējošie λ-fāgu rekombinantie peptīdi un šādi pozitīvi kloni iegūti monoklonālā veidā, lai, veicot DNS sekvenēšanu, noteiktu insertētās DNS sekvenci[24]. Šādai metodei piemīt vairākas priekšrocības salīdzinājumā ar iepriekšminētajām, piemēram, svaigu audzēja audu izmantošana ļauj kDNS bibliotēkā iekļaut lielāko daļu audzēja šūnās ekspresēto proteīnus kodējošo gēnu un izvairīties no in vitro artefaktiem. Metode ļauj arī detektēt ne tikai šūnas virsmas, bet arī iekššūnas antigēnus[25].
Lai gan SEREX koncepcija liekas vienkārša, veiksmīgai metodes pielietošanai nepieciešams apiet virkni tehnisku grūtību[26]:
-
Cilvēka serumā raksturīgas antivielas, kas reaģē ar baktērijas vai fāga komponentiem. Šī problēma parasti tiek risināta, atkārtoti absorbējot atšķaidītu serumu ar baktēriju un fāgu lizātu[27].
IgG ekspresējošu B šūnu klātbūtne audzējā rezultējas ar IgG kodējošu sekvenču iekļaušanos kDNS bibliotēkā un imunoskrīningā dod viltus pozitīvus signālus. Šīs problēmas risināšanai tiek izmantots preskrīnings[28].
Daļa no seruma antivielām, kas reaģē ar kDNS bibliotēku, ir autoantivielas, kurām ir maza vai vispār nekāda saistība ar audzēju. Šī problēma tiek risināta, izslēdzot IgM un lietojot serumu atšķaidījumā no 1:100 līdz 1:1000, lai fokusētos vienīgi uz augsta titra IgG[29].
Šobrīd eksistē liels skaits dažādu SEREX metodes modifikāciju, kuras var iedalīt sekojošās grupās[30]:
-
Variācijas kDNS bibliotēkas avota izvēlē;
Variācijas vektoru sistēmas izvēlē;
Variācijas antivielu avota izvēlē;
SEREX kombinācijā ar citām metodēm, piemēram, fāgu displeja tehnoloģijām vai sērijveida gēnu ekspresijas analīzēm (SAGE).
- ^van der Bruggen P., Traversari C., Chomez P., Lurquin C., De Plaen E., van der Eynde B., Knuth A., Boon T. 1991. A gene encoding an antigen recogniezd by cytolytic T lymphocytes on a human melanomas. Science, 254: 1643-1647.
- ^Yuichi O., Kohei T., Masahiro Y., Hiromi T., Toshitada Y. 2002. Immunogenic Gene Products in Cancer Patients Identified by SEREX. Biotherapy, 16(5): 433-440.
- ^Jäger E., Gnjatic S., Nagata Y., Stockert E., Jäger D., Karbach J., Neumann A., Rieckenberg J., Chen Y., Ritter G., Hoffman E., Arand M., Old L. J., Knuth A. 2000. Induction of primary NY-ESO-1 immunity: CD8+ T lymphocyte and antibody responses in peptide-vaccinated patients with NY-ESO-1+ cancers. PNAS, 97(22):12198-12203.
- ^Sahin U., Türeci Ö., Pfreundschuh M. 1997. Serological identification of human tumor antigēns. Current Opinion in Immunology, 9(5): 709-716.
- ^De Plaen E., Arden K., Traversari C., Gaforio J. J., Szikora J. P., De Smet C., Brasseur F., van der Bruggen P., Lethe B., Lurquin C. 1994. Structure, chromosomal localisation, and expression of 12 genes of the MAGE family. Immunogenetics, 40:360-369.
- ^Chen T., Scanln J., Sahin U., Türeci Ö., Gure A. O., Tsang S., Williamson S., Stockert E., Pfreundschuh M., Old L. J. 1997. A testicular antigen aberrantly epressed in human cancers detected by autologous antibody screening. Proct Natl Acad Sci USA, 94: 1914-1918.
- ^Jäger E., Gnjatic S., Nagata Y., Stockert E., Jäger D., Karbach J., Neumann A., Rieckenberg J., Chen Y., Ritter G., Hoffman E., Arand M., Old L. J., Knuth A. 2000. Induction of primary NY-ESO-1 immunity: CD8+ T lymphocyte and antibody responses in peptide-vaccinated patients with NY-ESO-1+ cancers. PNAS, 97(22):12198-12203.
- ^Coulie P. G., Brichard V., Van Pel A., Wölfel T., Schneider J., Traversari C., De Plaen E., Lurquin C., Raunald C. J., Boon T. 1994. A new gene coding for a differentiation antigen recognized by autologous cytolytic T-lymphocytes on HLA-A2 melanomas. J Exp Med, 180: 36-42.
- ^Sahin U., Türeci Ö., Pfreundschuh M. 1997. Serological identification of human tumor antigens. Current Opinion in Immunology, 9(5): 709-716.
- ^Jäger E., Gnjatic S., Nagata Y., Stockert E., Jäger D., Karbach J., Neumann A., Rieckenberg J., Chen Y., Ritter G., Hoffman E., Arand M., Old L. J., Knuth A. 2000. Induction of primary NY-ESO-1 immunity: CD8+ T lymphocyte and antibody responses in peptide-vaccinated patients with NY-ESO-1+ cancers. PNAS, 97(22):12198-12203.
- ^Viola A., Lanzavecchia A. 1996. T Cell Activation Determined by T cell receptor number and tunable thresholds. Science, 273: 104-106.
- ^Jäger E., Gnjatic S., Nagata Y., Stockert E., Jäger D., Karbach J., Neumann A., Rieckenberg J., Chen Y., Ritter G., Hoffman E., Arand M., Old L. J., Knuth A. 2000. Induction of primary NY-ESO-1 immunity: CD8+ T lymphocyte and antibody responses in peptide-vaccinated patients with NY-ESO-1+ cancers. PNAS, 97(22):12198-12203.
- ^Sahin U., Türeci Ö., Schmitt H., Cochlovius B., Johannes T., Schmits R., Stenner F., Lup G., Schobert I., Pfeundschuh M. 1995. Human neoplasms elict multiple specific immune responses in the autologous host. Proc Natl Acad Sci USA, 92: 11810-11813.
- ^Skipper J. C. A., Hendrickson R. C., Gulden P. H., Brichard V., Van Pel A., Chen Y., Shabanowitz J., Wölfel T., Slingluf C. L. J. R., Boon T. 1996. An HLA-A2-restricted tyrosinase antigen on melanoma cells results from posttranslational modification and suggests a novel pathway for processing of membrane proteins. J Exp Med, 183: 527-534.
- ^Chen W., Ede N. J., Jackon D. C., McClukey J., Purcell A. W. 1996. CTL recognition of an altered peptide associated with asparagine bond rearrangement. Implications for immunity and vaccine design. J Immunol, 157: 1000-1005.
- ^Ono M., Yasunaga T., Miyta T., Ushikubo H. 1986. Nucleotide sequence of human endogenous retrovirus genome related to the mouse mammary tumor virus genome. J Virol, 60: 589-598.
- ^Sahin U., Türeci Ö., Pfreundschuh M. 1997. Serological identification of human tumor antigens. Current Opinion in Immunology, 9(5): 709-716.
- ^Ludwig Institute For Cancer Research 2007. Cancer Antigen Identification. http://www.licr.org/D_programs/d4a1.php
- ^Yang F., Chen I. H., Xiong Z., Yan Y., Wang H., Yang X. F. 2006. Model of stimulation-responsive splicing and strategies in identification of immunogenic isoforms of tumor antigens and autoantigens. Clin Immunol, 121(2): 121-33.
- ^Yang F., Yang X. F. 2005. New concepts in tumor antigens: their significance in future immunotherapies for tumors. Cell Mol Immunol, 2(5):331-41.
- ^Yang F., Yang X. F. 2005. New concepts in tumor antigens: their significance in future immunotherapies for tumors. Cell Mol Immunol, 2(5):331-41.
- ^Ludwig Institute For Cancer Research 2007. Cancer Antigen Identification. http://www.licr.org/D_programs/d4a1.php
- ^Ludwig Institute For Cancer Research 2007. Cancer Antigen Identification. http://www.licr.org/D_programs/d4a1.php
- ^Sahin U., Türeci Ö., Pfreundschuh M. 1997. Serological identification of human tumor antigens. Current Opinion in Immunology, 9(5): 709-716.
- ^Tűreci O., Sahin U., Pfreundschuh M. 1997. Serological analysis of human tumor antigens: molecular definition and implications. Molecular Medicine Today, 3(8):342-349.
- ^Chen Y. T., Scanlan M. J., Obata Y., Old L. J. 2004. Identification of Human Tumor Antigens by Serological Expression Cloning: An Online Review on SEREX. http://www.cancerimmunity.org/SEREX/index.htm
- ^Chen Y. T., Scanlan M. J., Obata Y., Old L. J. 2004. Identification of Human Tumor Antigens by Serological Expression Cloning: An Online Review on SEREX. http://www.cancerimmunity.org/SEREX/index.htm
- ^Chen Y. T., Scanlan M. J., Obata Y., Old L. J. 2004. Identification of Human Tumor Antigens by Serological Expression Cloning: An Online Review on SEREX. http://www.cancerimmunity.org/SEREX/index.htm
- ^Chen Y. T., Scanlan M. J., Obata Y., Old L. J. 2004. Identification of Human Tumor Antigens by Serological Expression Cloning: An Online Review on SEREX. http://www.cancerimmunity.org/SEREX/index.htm
- ^Chen Y. T., Scanlan M. J., Obata Y., Old L. J. 2004. Identification of Human Tumor Antigens by Serological Expression Cloning: An Online Review on SEREX. http://www.cancerimmunity.org/SEREX/index.htm