Tu atrodies šeit: Sākums » Vēža imūnrediģēšana
Navigācija
- Sākums
- Ļaundabīgo audzēju raksturojums
- Neierobežots proliferācijas potenciāls
- Izvairīšanās no apoptozes
- Spēja metastazēt
- Spēja inducēt angioģenēzi
- Nejutība pret ārējiem augšanu inhibējošiem faktoriem
- Augšanas faktoru pašpietiekamība
- Vēža imūnrediģēšana
- Audzēju antigēni
- Saites
Vēža imūnrediģēšana
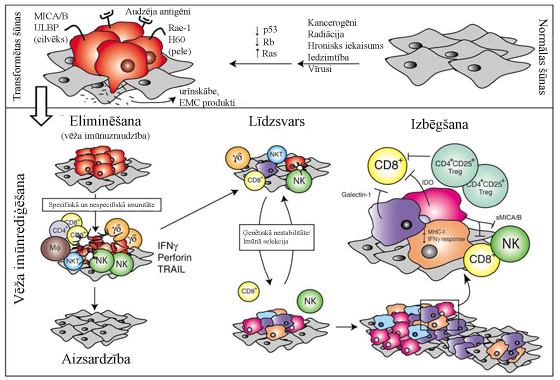
Imūnsistēmas nespecifisko un specifisko mehānismu kopumu, kas nodrošina aizsardzību pret vēža attīstību, sauc par vēža imūnrediģēšanu. Vēža imūnrediģēšana norisinās trīs fāzēs eliminēšanas fāzē, līdzsvara fāzē un izbēgšanas fāzē[1](4. attēls):
-
Eliminēšanas fāze
- Imūnsupresīvu citokīnu sintēze
- Antigēnu neekspresēšana
- Nejutība pret interferonu-γ
Eliminēšanas fāze reprezentē vēža imūnuzraudzības koncepciju, ietverot nespecifiskās un specifiskās imunitātes mehānismu kompleksu darbību, lai eliminētu transformētas šūnas. Pilnīga imūnrediģēšanas procesa gadījumā vēža šūnas tiek eliminētas šajā fāzē, nesasniedzot līdzsvara un izbēgšanas fāzes. Eliminēšanas fāze tiek iedalīta četros soļos[2]:
-
Audzēja šūnu izdalīti pre-iekaisuma faktori un hemokīni izsauc nespecifiskās imūnās sistēmas šūnu rekrutāciju uz audzēja saitu[3]. Sasniedzot audzēju, NKT, γδT, NK šūnas un/vai makrofāgi spēj atpazīt tādas audzēja šūnām raksturīgas molekulas kā, piemēram, NKG2D ligandus[4]. Šādai audzēja šūnām specifisku molekulu atpazīšanai ir kritiska loma turpmākā imūnās sistēmas pretvēža aktivitātē, kas raksturojas ar interferona-γ producēšanu.
Imūnsistēmas šūnu atbrīvotais interferons-γ izraisa lokālu hemokīnu sintēzi, izsaucot papildus imūnās sistēmas šūnu rekrutāciju uz audzēja saitu un ekstracelulārā matriksa remodelēšanas blakusprodukti stimulē audzējā infiltrējušos makrofāgus izdalīt nelielu daudzumu Interleikīna-12[5], kas, savukārt, liek audzējā infiltrējušām NK šūnām izdalīt nelielu daudzumu interferona-γ, stimulējot makrofāgus izdalīt papildus interleikīnu-12, kā rezultātā, mijiedarbojoties makrofāgiem un NK šūnām, tiek izdalīts liels daudzums interferona-γ[6], izsaucot virkni interferona-γ atkarīgo procesu, tai skaitā antiproliferatīvos, pre-apoprotiskos un angiostatiskos, kas izraisa daļas audzēja šūnu bojāeju un audzēja antigēnu izdalīšanos ekstracelulārajā telpā.
Nespecifiskās imūnās sistēmas darbības rezultātā iznīcināto audzēja šūnu antigēnus vai antigēnus saturošās atliekasendocitozes ceļā uzņem uz audzēja saitu rekrutētas dendrītiskās šūnas. Antigēnus nesošas nobriedušas dendrītiskās šūnas migrē uz limfmezgliem[7], kur tās kalpo kā starpposms starp nespecifisko un specifisko imūno sistēmu, procesētus antigēnus kopā ar MHC II vai MHC I klases molekulām prezentējot attiecīgi CD4+ Th šūnām un CD8+ Tc šūnām, kas izsauc attiecīgo šūnu aktivāciju.
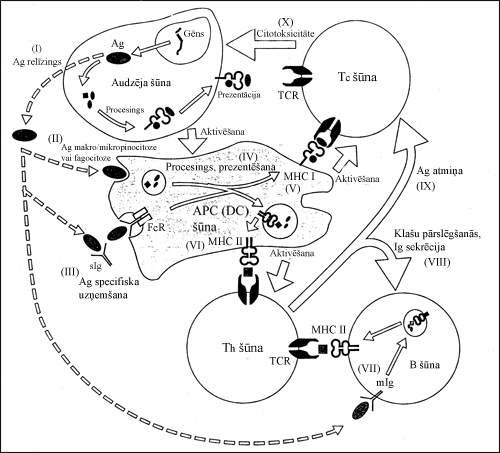 Antigēnus ar membrānas Ig starpniecību uzņem arī B šūnas, kas tos procesē un prezentē Th šūnām kopā ar MHC II klases molekulām. Dendrītisko APC šūnu un B šūnu antigēnu prezentācija Th šūnām ierosina klašu pārslēgšanos un Ig produkciju B šūnās, kā arī ilgstošu antigēnu atmiņu T šūnām[8] (5. attēls).
Šajā solī norisinās audzēja specifisku CD4+ Th un CD8+ Tc šūnu rekrutācija uz audzēja saitu un pilnīga audzēja eliminēšana. Audzēja specifiskās CD8+ Tc šūnas efektīvi atpazīst vēža šūnas un eliminē tās, izmantojot gan tiešus, gan netiešus mehānismus[9].
Antigēnus ar membrānas Ig starpniecību uzņem arī B šūnas, kas tos procesē un prezentē Th šūnām kopā ar MHC II klases molekulām. Dendrītisko APC šūnu un B šūnu antigēnu prezentācija Th šūnām ierosina klašu pārslēgšanos un Ig produkciju B šūnās, kā arī ilgstošu antigēnu atmiņu T šūnām[8] (5. attēls).
Šajā solī norisinās audzēja specifisku CD4+ Th un CD8+ Tc šūnu rekrutācija uz audzēja saitu un pilnīga audzēja eliminēšana. Audzēja specifiskās CD8+ Tc šūnas efektīvi atpazīst vēža šūnas un eliminē tās, izmantojot gan tiešus, gan netiešus mehānismus[9].
Līdzsvara fāzē starp imūno sistēmu un audzēja šūnām iestājas dinamisks līdzsvars, kas raksturojas ar uz izdzīvojušām audzēja šūnām vērstu imūnās sistēmas darbības izraisītu selekcijas spiedienu, kā rezultātā audzēja augšana tiek ierobežota, to pilnībā neiznīcinot.[10]. Šī fāze, iespējams, ir visgarākā no imūnrediģēšanas trīs fāzēm un var ilgt vairākus gadus[11]. Šajā periodā galvenie mehānismi, kas audzējam ļauj pārciest pastāvīgus imūnās sistēmas uzbrukumus, ir audzēja šūnu heterogenitāte un ģenētiskā nestabilitāte[12]. Izbēgšanas fāze
Izbēgšanas fāzē uz audzēja šūnām vairs nedarbojas imūnās sistēmas spiediens, jo tās ieguvušas rezistenci pret imūnās sistēmas iedarbības mehānismiem, imūnsupresīvu aktivitāti un/vai īpašības, kas ļauj tām palikt neredzamām imūnās sistēmas šūnām Šādas audzēja šūnu īpašības nosaka dažādi mehānismi, piemēram[13]:
- ^Dunn G. P., Old L. J., Schreiber R. D. 2004. The three es of cancer immunoediting. Annual Review of Immunology, 22: 329-360.
- ^Dunn G. P., Old L. J., Schreiber R. D. 2004. The three es of cancer immunoediting. Annual Review of Immunology, 22: 329-360.
- ^Wrenshall L. E., Stevens R. B., Cerra F. B., Platt J. L. 1999. Modulation of macrophage B and cell function by glycosaminoglycans. J. Leukoc. Biol., 66: 391-400.
- ^Benlagha K., Bendelac A. 2000. CD1d restricted mouse Vα14 T cells: lymphocytes of innate immunity. Semin. Immunol., 12: 537-542.
- ^Hodge-Dufour J., Noble P. W., Horton M. R., Bao C., Wysoka M. 1997. Induction of IL-12 and chemokines by hyaluronan requires adhesion - dependent priming of resident but not elicted macrophages. J. Immunol, 159: 2492-2500.
- ^Bancroft G. J., Schreiber R. D., Unanue E. R. 1991. Natural immunity: a T-cell-independent pathway of macrophage activation, defined in the scid mouse. Immunol. Rev., 124: 5-24.
- ^Dunn G. P., Old L. J., Schreiber R. D. 2004. The three es of cancer immunoediting. Annual Review of Immunology, 22: 329-360.
- ^Sahin U., Türeci Ö., Pfreundschuh M. 1997. Serological identification of human tumor antigens. Current Opinion in Immunology, 9(5): 709-716.
- ^Dunn G. P., Old L. J., Schreiber R. D. 2004. The three es of cancer immunoediting. Annual Review of Immunology, 22: 329-360.
- ^Dunn G. P., Old L. J., Schreiber R. D. 2004. The three es of cancer immunoediting. Annual Review of Immunology, 22: 329-360.
- ^Loeb L. A., Loeb K. R., Anderson J. P. 2003. Multiple mutations and cancer. Proc. Natl. Acad. Sci. USA, 100: 776-781.
- ^Loeb L. A. 1991. Mutator phenotype may be required for multistage carcinogenesis. Cancer Res., 51: 3075-3079.
- ^Dunn G. P., Old L. J., Schreiber R. D. 2004. The three es of cancer immunoediting. Annual Review of Immunology, 22: 329-360.