Tu atrodies šeit: Sākums » Ļaundabīgo audzēju raksturojums
Navigācija
- Sākums
- Ļaundabīgo audzēju raksturojums
- Neierobežots proliferācijas potenciāls
- Izvairīšanās no apoptozes
- Spēja metastazēt
- Spēja inducēt angioģenēzi
- Nejutība pret ārējiem augšanu inhibējošiem faktoriem
- Augšanas faktoru pašpietiekamība
- Vēža imūnrediģēšana
- Audzēju antigēni
- Saites
Ļaundabīgo audzēju raksturojums
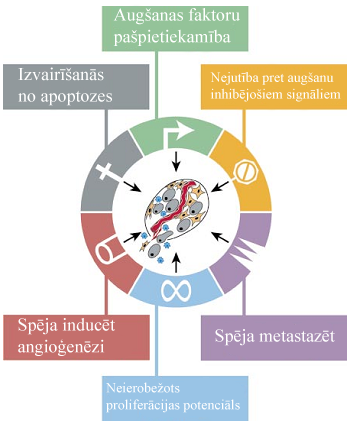
Vēzis ir vairāk kā 100 dažādu slimību grupa, kuru galvenā kopīgā pazīme ir nekontrolēta šūnu augšana. Vēzis attīstās, transformējoties normālām organisma šūnām procesā, ko sauc par karcinoģenēzi[1]. Karcinoģenēzi var inducēt gan ārēji (ķīmiskas vielas, jonizējoša radiācija, vīrusi), gan iekšēji (hormoni, imūnsistēmas stāvoklis, iedzimtas mutācijas) faktori. Šo faktoru kombinētas vai secīgas iedarbības rezultātā var tikt sekmēta vai ierosināta vēža formēšanās. Karcinoģenēze ir komplicēts daudzpakāpju process, kas ietver ģenētisku un epiģenētisku izmaiņu akumulēšanos, kas ir priekšnosacījums tādām pārmaiņām šūnas bioķīmiskajos ceļos, kas izsauc sekojošas vēža šūnām raksturīgas pazīmes[2] (1.attēls):
-
Neierobežots proliferācijas potenciāls
Replicējoties lineārām hromosomām, notiek hromosomu saīsināšanās, jo, degradējoties praimerim no atpaliekošās ķēdes 5 gala, DNS polimerāze 5 galā vairs nespēj pievienot jaunus nukleotīdus, jo nav vietas jaunam praimerim. Hromosomu no šādas degradācijas pasargā TTAGGG (cilvēkam) heksanukleotīdu atkārtojumi hromosomu galos jeb telomēras, kuru garums nosaka šūnas proliferācijas potenciālu, kas normālām cilvēka šūnām nodrošina spēju dalīties aptuveni 50 reizes (Haiflika robeža)[3]. Daļai cilmes šūnu eksistē enzīms telomerāze, kas spēj pagarināt telomēras, nodrošinot šīm šūnām neierobežotu proliferācijas potenciālu. Telomerāze raksturīga gandrīz visām vēža šūnām[4]. Tomēr liela daļa vēža šūnu izmanto alternatīvo telomēru pagarināšanas mehānismu (ALT, alternative lengthening of telomeres), kas balstās uz telomēru apmaiņu starp māshromatīdām[5]. Izvairīšanās no apoptozes
Apoptoze ir viens no galvenajiem programmētās šūnu nāves veidiem, kas tiek palaists ārēju vai iekššūnas signālu ietekmē un ir raksturīgs praktiski visām normālām šūnām. Vēža šūnas ir nejutīgas pret apoptozi izsaucošiem faktoriem. Šādu nejutību pret apoptotiskiem signāliem vai apoptotisko signālu trūkumu var izsaukt dažādi mehānismi, piemēram:
-
XIAP overekspresija (raksturīga plaušu vēzim). XIAP (X-linked inhibitor of apoptosis protein) ir kaspāzes 3, kaspāzes 7 un kaspāzes 9 inhibītors. Kaspāzes aktivē mitohondriju citohroms c, izkļūstot citosolā, kā rezultātā tiek palaists iekšējais apoptozes ceļš. Kaspāze 9 iesaistīta arī ārējā apoptozes ceļā. Šāda kaspāžu inaktivācija noved pie apoptotisko ceļu disfunkcijas [6].
Traucējumi p53 ceļā. p53 ir audzējsupresorproteīns, kas uzkrājas DNS bojājumu gadījumā un apstādina šūnas ciklu G1 stadijā, dodot šūnai laiku DNS reparācijai, tomēr, ja bojājumi ir pārāk plaši vai reparācija nav sekmīga, p53 inducē apoptozi, stimulējot BCL-2 asociētā X proteīna (BAX) veidošanos, kurš inducē citohroms c izdali citoplazmā. p53 gēna transkripciju izsauc interferoni α un β. Mutācijas p53 vai interferonu gēnos izsauc apoptozes traucējumus DNS bojājumu gadījumos[7][8]
Onkovīrusi. Daudzi vīrusi kodē apoptozes inhibītorus[9], piemēram, BCL-2 homologus, kas spēj inhibēt tādus pro-apoptotiskos proteīnus kā BAX un BAK, kas ir nozīmīgs apoptozes iekšējā ceļā kā citohroma c relīzinga faktors[10]. Virālo BCL-2 kodē, piemēram, Epšteina-Barra vīruss, kas var izraisīt Burkitta limfomu un aizdegunes karcinomu[11]. Nereti vīrusi kodē arī kaspāžu un p53 inhibītorus vai attiecīgo gēnu represorus. Piemēram, cilvēka papilomas vīrusa (HPV) onkogēnu kodētais onkoproteīns E6 saistoties pie p53, izraisa tā degradāciju, savukārt HPV E7 proteīns saistās pie retinoblastomas audzējsupresorgēna produkta pRb[12].
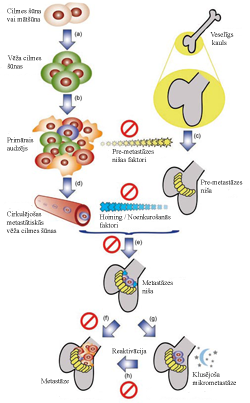 Spēja metastazēt ir sarežģīts un līdz galam neizprasts process, kas raksturojas ar primārā audzēja šūnu izplatību pa limfātisko un asinsrites sistēmu, līdz tās sasniedz piemērotus orgānus, kuros veido sekundārus audzējus metastāzes. Pētījumi liecina, ka metastāžu formēšana ir ļoti mazefektīvs process, jo tikai 0,01% asinsritē iekļuvušu vēža šūnu ir spējīgas metastazēt[13], turklāt pastāv sakarība starp primārā audzēja lokalizāciju un metastāžu izplatību, piemēram, kolorektālais vēzis visbiežāk veido metastāzes aknās, bet priekšdziedzera vēzis kaulos[14]. Šāds metastāžu orgānu specifiskums sākotnēji tika skaidrots ar asinsrites sistēmas morfoloģiju, jo, tā kā vēža šūnas ir ievērojami lielākas par asinsķermenīšiem, tām vajadzētu tikt aizturētām kapilāros, tiklīdz tās sasniegušas pirmo orgānu savā ceļā[15], taču šo ideju nopietni iedragāja Stefana Pegeta 1889. gadā izvirzītā sēklas un augsnes hipotēze, kas paredzēja, ka vēža šūnas spēj izdzīvot un proliferēt vienīgi noteiktos audos, kas nodrošina nepieciešamo mikrovidi un augšanas faktorus[16]. Šobrīd pētījumi vedina uz domām, ka primārais audzējs izdala īpašus pre-metastāzes nišas faktorus, kuri noteiktos audos ierosina pre-metastāzes nišas formēšanos. Pre-metastāzes niša, savukārt, izdala migrēšanas (homing) un noenkurošanās (anchorage) faktorus, kas, darbojoties kā hemoatraktanti, pievilina vēža cilmes šūnas, kas atdalījušās no primārā audzēja. Kad vēža cilmes šūna sasniedz pre-metastāzes nišu, tā sāk formēt metastāzes nišu, no kuras tālāk var attīstīties metastāze vai neaktīva mikrometastāze (2.attēls). Metastāzes ir nāves cēlonis 90% vēža gadījumos[17].
Spēja metastazēt ir sarežģīts un līdz galam neizprasts process, kas raksturojas ar primārā audzēja šūnu izplatību pa limfātisko un asinsrites sistēmu, līdz tās sasniedz piemērotus orgānus, kuros veido sekundārus audzējus metastāzes. Pētījumi liecina, ka metastāžu formēšana ir ļoti mazefektīvs process, jo tikai 0,01% asinsritē iekļuvušu vēža šūnu ir spējīgas metastazēt[13], turklāt pastāv sakarība starp primārā audzēja lokalizāciju un metastāžu izplatību, piemēram, kolorektālais vēzis visbiežāk veido metastāzes aknās, bet priekšdziedzera vēzis kaulos[14]. Šāds metastāžu orgānu specifiskums sākotnēji tika skaidrots ar asinsrites sistēmas morfoloģiju, jo, tā kā vēža šūnas ir ievērojami lielākas par asinsķermenīšiem, tām vajadzētu tikt aizturētām kapilāros, tiklīdz tās sasniegušas pirmo orgānu savā ceļā[15], taču šo ideju nopietni iedragāja Stefana Pegeta 1889. gadā izvirzītā sēklas un augsnes hipotēze, kas paredzēja, ka vēža šūnas spēj izdzīvot un proliferēt vienīgi noteiktos audos, kas nodrošina nepieciešamo mikrovidi un augšanas faktorus[16]. Šobrīd pētījumi vedina uz domām, ka primārais audzējs izdala īpašus pre-metastāzes nišas faktorus, kuri noteiktos audos ierosina pre-metastāzes nišas formēšanos. Pre-metastāzes niša, savukārt, izdala migrēšanas (homing) un noenkurošanās (anchorage) faktorus, kas, darbojoties kā hemoatraktanti, pievilina vēža cilmes šūnas, kas atdalījušās no primārā audzēja. Kad vēža cilmes šūna sasniedz pre-metastāzes nišu, tā sāk formēt metastāzes nišu, no kuras tālāk var attīstīties metastāze vai neaktīva mikrometastāze (2.attēls). Metastāzes ir nāves cēlonis 90% vēža gadījumos[17].Pēdējos gados atzinību ir guvusi ideja, ka metastatiskajos procesos var tikt iesaistīti epiteliāli mezenhimālās tranzīcijas (EMT) mehānismi, kas pirmo reizi novēroti embrionālajā attīstībā kā epiteliālo šūnu konversija mezenhimālā fenotipā, zaudējot polaritāti un starpšūnu kontaktus, kā arī notiekot būtiskām izmaiņām citoskeleta struktūrā, kas rezultējas ar spēju ekspresēt mezenhimālos proteīnus un migrēt, šādi spēlējot nozīmīgu lomu embrija attīstībā[18]. Domājams, ka epiteliālā audzēja gadījumā var tikt izmantoti EMT mehānismi, lai konvertētu diferencētas vēža šūnas dediferencētās šūnās ar palielinātu metastātisko potenciālu[19]. Spēja inducēt angioģenēzi
Sakarā ar barības vielu un skābekļa trūkumu, nevaskularizēts audzējs parasti nepārsniedz 2mm3 tilpumu, tādēļ ļoti būtisku lomu audzēja attīstībā spēlē audzēja šūnu spēja inducēt angioģenēzi[20]. Audzēja šūnu spēja inducēt angioģenēzi balstās uz tādu augšanas faktoru produkciju un sekrēciju, kas veicina asinsvadu zarošanos un augšanu. No šādiem faktoriem visbiežāk sastopami VEGF(vaskulārā endotēlija augšanas faktors) un bFGF (galvenais fibroblastu augšanas faktors)[21]. Šobrīd zināms, ka audzēja šūnas nespēj producēt enzīmu PKG(cGMP atkarīgā proteīnkināze G). Normālās šūnās PKG ierobežo β-katenīnu, kas stimulē angioģenēzi[22]. Nejutība pret ārējiem augšanu inhibējošiem faktoriem
Normālos audos tiek uzturēta homeostāze ar augšanu inhibējošiem signāliem, kas darbojas pretī augšanas faktoru ietekmei, novirzot šūnu pārejošā miera stāvoklī vai postmitotiskā stāvoklī, kas saistīts ar šūnas diferencēšanos un proliferācijas potenciāla zudumu. Daudzi, iespējams, visi, antiproliferatīvie signāli tiek novadīti caur retinoblastomas proteīnu pRb un diviem tā radiniekiem p107 un p130. Traucējumi pRb ceļā ļauj vēža šūnai proliferēt arī augšanas inhibītoru klātbūtnē[23]. Augšanas faktoru pašpietiekamība
Lai šūna spētu proliferēt, tai jāsaņem ekstracelulāri augšanas faktori. Vēža šūnas spēj pašas sintezēt daļu no nepieciešamajiem augšanas faktoriem, uz kuriem arī pašas autokrīni atbild[24]. Dažos gadījumos vēža šūnas pilnībā zaudējušas nepieciešamību pēc noteiktiem augšanas faktoriem, piemēram, RAS protoonkogēna mutācijas gadījumā var translēties hiperaktīvs RAS G-proteīns, kas ir aktīvs, pat ja pie atbilstoša membrānas receptora nesaistās augšanas faktors[25].
Šobrīd pastāv divi konkurējoši modeļi, kas mēģina izskaidrot audzēja attīstību[26]:
-
Stohastiskais modelis paredz, ka jebkura audzēja šūna ir tumorigēna un tās ieiešanu šūnas ciklā nosaka gadījuma rakstura notikumi.
Hierarhijas modelis paredz, ka tikai neliela audzēja šūnu subpopulācija ir atbildīga par audzēja augšanu un metastāžu formēšanos. Šis modelis ir pamatā vēža cilmes šūnu hipotēzei.
Vēža cilmes šūnu eksistenci jau 1855. gadā paredzēja R. Virhovs, izvirzot hipotēzi, ka audzējs attīstās no šūnām, kas līdzinās embrionālām cilmes šūnām[27], taču tā laika tehnoloģijas nebija pietiekami attīstītas, lai sniegtu iespēju pārbaudīt šo hipotēzi, tādēļ pirmie taustāmie pierādījumi vēža cilmes šūnu pastāvēšanai tika iegūti tikai 1994. gadā, kad akūtā mieloīdā limfomā tika atrastas šūnas ar virsmas fenotipu CD34+/CD38-, kas ir raksturīgs šūnām ar cilmes šūnu īpašībām[28]. Turpmākajos gados līdzīgas cilmes-veida šūnas tika atrastas arī virknē citu audzēju tipu. Noskaidrots, ka aizkuņģa dziedzera, resnās zarnas un smadzeņu audzēju cilmes-veida šūnām raksturīgs cilmes šūnu virsmas glikoproteīns CD133. Injicējot resnās zarnas vēža CD133+ šūnas pelēm ar novājinātu imūnsistēmu, daudzos gadījumos tās izrādīja spēju formēt metastāzes, turpretī neviena no 104 injicētām CD133- šūnām šādu spēju neizrādīja[29]. Turpinoties pētījumiem, iegūtie pierādījumi vēža cilmes šūnu pastāvēšanai bija neapstrīdami, tādēļ radās nepieciešamība precīzi definēt vēža cilmes šūnas. Šādu vēža cilmes šūnu definīciju 2006. gadā sniedz M. F. Klērks: Vēža cilmes šūnas ir audzēja šūnas, kam piemīt spēja veidot heterogēnas vēža šūnu līnijas un pašatjaunoties[30], kur ar pašatjaunošanos būtu jāsaprot vēža cilmes šūnu spēju asimetriski daloties, ne tikai veidot heterogēnas diferencētu vēža šūnu populācijas, bet arī saglabāt vēža cilmes šūnu līniju.
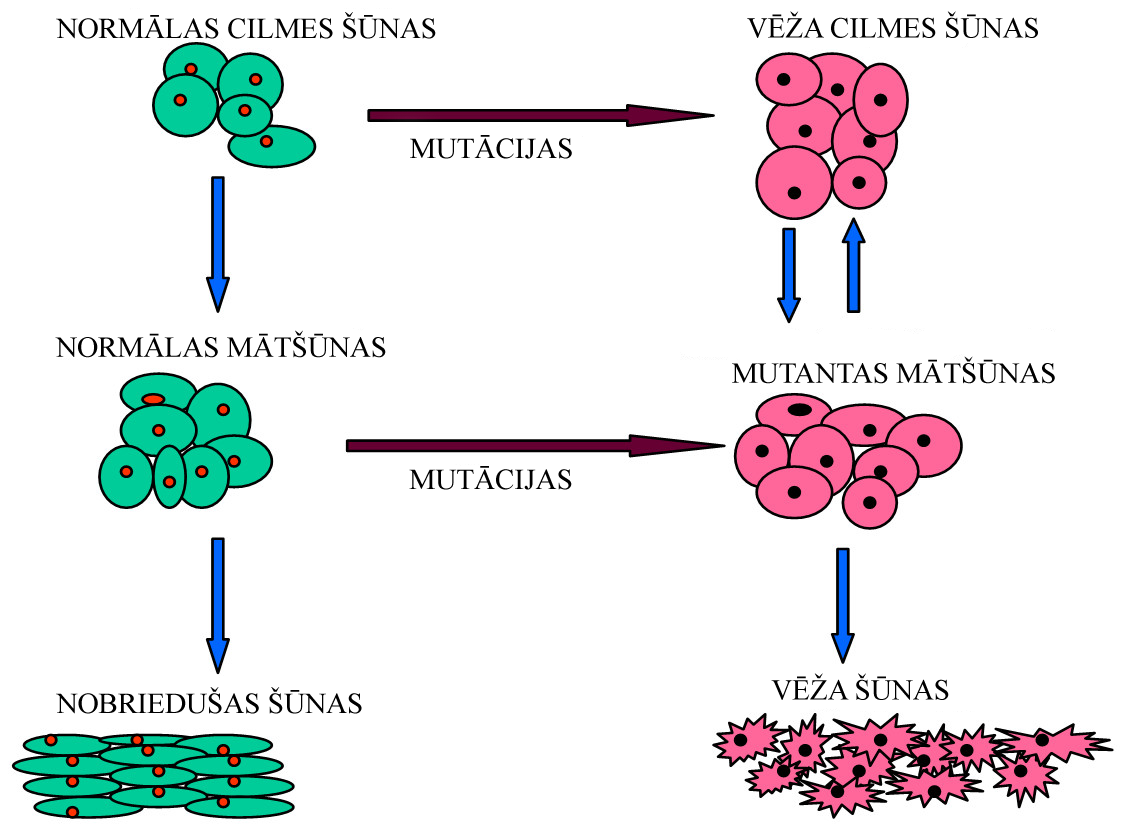 Viens no vēža cilmes šūnu izpētes pamatjautājumiem ir šo šūnu neskaidrā izcelsme. Ja šādu šūnu avots ir nobriedušas, diferencētas šūnas, dediferenciācijā un pašatjaunošanās spēju nodrošināšanā galveno lomu spēlētu akumulētu onkogēnu mutāciju kopums, taču šī hipotēze ir maz ticama, jo diferencētu šūnu mūža ilgums vairumā gadījumu ir pārāk īss, lai tās spētu akumulēt visas nepieciešamās mutācijas, līdz ar to daudz ticamākas šķiet versijas, kas paredz vēža cilmes šūnu attīstību no normālām cilmes šūnām vai mātšūnām[31] (3. attēls), tomēr jauni pētījumi parāda, ka nepieciešama vienīgi Oct-4, c-Myc, Sox2 un klf4 koekspresija, lai nobriedušus fibroblastus pārvērstu par šūnām, kas morfoloģiski un fizioloģiski līdzinās embrionālām cilmes šūnām[32]. Turpretī, ja vēža cilmes šūnas attīstās, transformējoties normālām cilmes šūnām, pašatjaunošanās spējas nodrošināšanai tās varētu izmantot jau eksistējošus regulatoros ceļus, taču, tā kā cilmes šūnas ir sastopamas ārkārtīgi reti, ticamāka ir versija par vēža cilmes šūnu izcelsmi no mātšūnām (progenitor cells)[33][34], ko apstiprina arī novērojumi, ka Bcl-2 un BCR/ABL (sastopams 90% hroniskas mieloīdas leikēmijas gadījumos) koekspresija mieloīdās mātšūnās ir pietiekama, lai izraisītu leikēmiju pelēm[35].
Viens no vēža cilmes šūnu izpētes pamatjautājumiem ir šo šūnu neskaidrā izcelsme. Ja šādu šūnu avots ir nobriedušas, diferencētas šūnas, dediferenciācijā un pašatjaunošanās spēju nodrošināšanā galveno lomu spēlētu akumulētu onkogēnu mutāciju kopums, taču šī hipotēze ir maz ticama, jo diferencētu šūnu mūža ilgums vairumā gadījumu ir pārāk īss, lai tās spētu akumulēt visas nepieciešamās mutācijas, līdz ar to daudz ticamākas šķiet versijas, kas paredz vēža cilmes šūnu attīstību no normālām cilmes šūnām vai mātšūnām[31] (3. attēls), tomēr jauni pētījumi parāda, ka nepieciešama vienīgi Oct-4, c-Myc, Sox2 un klf4 koekspresija, lai nobriedušus fibroblastus pārvērstu par šūnām, kas morfoloģiski un fizioloģiski līdzinās embrionālām cilmes šūnām[32]. Turpretī, ja vēža cilmes šūnas attīstās, transformējoties normālām cilmes šūnām, pašatjaunošanās spējas nodrošināšanai tās varētu izmantot jau eksistējošus regulatoros ceļus, taču, tā kā cilmes šūnas ir sastopamas ārkārtīgi reti, ticamāka ir versija par vēža cilmes šūnu izcelsmi no mātšūnām (progenitor cells)[33][34], ko apstiprina arī novērojumi, ka Bcl-2 un BCR/ABL (sastopams 90% hroniskas mieloīdas leikēmijas gadījumos) koekspresija mieloīdās mātšūnās ir pietiekama, lai izraisītu leikēmiju pelēm[35].
Jauns modelis paredz vēža cilmes šūnu rašanos cilmes šūnu saplūšanas rezultātā. Konceptuāli, saplūšana starp cilmes šūnām un mutantām šūnām var novest pie pašatjaunošanās potenciāla atgūšanas. Neseni pētījumi parāda, ka kaulu smadzeņu BMDC šūnas ir spējīgas saplūst ar neoplastiskām epitēlija šūnām[36] Šāds šūnu saplūšanas modelis spētu izskaidrot audzēja šūnām bieži raksturīgo aneiploīdiju[37]. Par labu šai hipotēzei liecina arī daudziem vīrusiem piemītoša spēja sapludināt šūnas[38].
Pretstatā klasiskajam gadījumam, kad vēzis ir piesaistīts konkrētam saimniekorganismam, no kura šūnas, tas ir attīstījies, zināmi arī divi kontagiozi vēža tipi suņu seksuāli transmisīvais vēzis (CTVT, infekciozā sarkoma) un Tasmānijas velnsomaiņu sejas vēzis (DFTD). Sākotnēji tika domāts, ka abos gadījumos vēzi izraisa kāds vīruss, līdzīgi kā HPV var izsaukt dzemdes kakla vēzi, taču šobrīd ir zināms, ka pārnesējaģents ir pati vēža šūna, kas pirmajā gadījumā izplatās seksuālu kontaktu ceļā suņu un citu Canis ģints sugu populācijās, bet otrajā gadījumā barošanās, savstarpējo cīņu un agresīvas pārošanās laikā Tasmānijas velnsomaiņu (Sarcophilus harrisii) populācijās[39].
- ^Cooper G. M. 1993. The cancer book: a guide to understanding the causes, prevention, and treatment of cancer. Boston: Jones & Bartlett Publishers, 236 pp.
- ^Hanahan D., Weinberg R. A. 2000. The hallmarks of cancer. Cell, 100: 57-70.
- ^Perkel J. M. 2002. Telomeres as the key to cancer. The Scientist, 16: 1111, 38-40.
- ^Shay J. W., Zou Y., Hiyama E., Wright W. E. 2001. Telomerase and cancer. Human Molecular Genetics, 7: 677-685.
- ^Bryan T.M., Englezou A., Gupta J., Bacchetti S., Reddel R.R. 1995. Telomere elongation in immortal human cells without detectable telomerase activity. EMBO J, 14(17): 42404248.
- ^Yang L., Mashima T., Sato S., Mochizuki M., Sakamoto H., Yamori T., Oh-Hara T., Tsuruo T. 2003. Predominant Suppression of Apoptosome by Inhibitor of Apoptosis Protein in Non-Small Cell Lung Cancer H460 Cells. Cancer Research, 63: 831-837.
- ^Takaoka A., Hayakawa S., Yanai H., Stoiber D., Negishi H., Kikuchi H., Sasaki S., Imai K., Shibue T., Honda K., Taniguchi T. 2003. Integration of interferon-alpha/beta signalling to p53 responses in tumour suppression and antiviral defence. Nature, 424(6948): 516-523.
- ^Hanahan D., Weinberg R. A. 2000. The hallmarks of cancer. Cell, 100: 57-70.
- ^Teodoro J. G., Branton P. E. 1997. Regulation of apoptosis by viral gene products. J Virol. 71(3): 17391746.
- ^Polster B. M., Pevsner J., Hardwick J. M. 2004. Viral Bcl-2 homologs and their role in virus replication and associated diseases. Biochimica et Biophysica Acta 1644: 211-227.
- ^Henderson S., Huen D., Rowe M., Dawson C., Johnson G., Rickinson A. 1993. Epstein-Barr virus-coded BHRF1 protein, a viral homologue of Bcl-2, protects human B cells from programmed cell death. Proc Natl Acad Sci USA, 90(18): 84798483.
- ^Münger K., Scheffner M., Huibregtse J. M., Howley P. M. 1992. Interactions of HPV E6 and E7 oncoproteins with tumour suppressor gene products. Cancer Surv, 12: 197-217.
- ^Fidler I. J. 1970. Metastasis: quantitative analysis of distribution and fate of tumor emboli labeled with 125I-5iodo-2-deoxyuridine. J. Natl Cancer Inst, 45: 773-782.
- ^Pantel K., Brakenhoff R. H. 2004. Dissecting the metastatic cascade. Nat Rev Cancer, 4: 448-456
- ^Ewing J. 1928. A treatise on tumors. In: Neoplastic diseases. London: WB Saunders Co, 77-89 pp.
- ^Fidler I. J. 2001. Seed and soil revisited: contribution of the organ microenvironment to cancer metastasis. Surg Oncol Clin N Am, 10: 257-269.
- ^Li F., Tiede B., Massagu J., Kang Y. 2007. Beyond tumorigenesis: cancer stem cells in metastasis. Cell Researh, 17: 3-14.
- ^Thiery J. P. 2002. Ephitelial-mesenchymal transitions in tumor progression. Nat Rev Cancer, 2: 442-454.
- ^Kang Y., Massague J. 2004. Epithelial-mesenchymal transitions: twist in development and metastasis. Cell, 118: 277-279.
- ^Schmitt F. C., Soares R. 1999. TGF-[alpha] and Angiogenesis. The American Journal of Surgical Pathology, 23(3): 358-359.
- ^Eppenberger U., Kueng W., Schlaeppi J. M., Roesel J. L., Benz C., Mueller H., Matter A., Zuber M., Luescher K., Litschgi M., Schmitt M., Foekens J. A., Eppenberger-Castori S.1998. Markers of tumor angiogenesis and proteolysis independently define high and low-risk subsets of node-negative breast cancer patients. Journal of Clinical Oncology, 16: 3129-3136.
- ^Kwon I . K., Schoenlein P. V., Delk J., Liu K., Thangaraju M., Dulin N. O., Ganapathy V., Berger F. G., Browning D. D. 2008. Expression of cyclic guanosine monophosphate-dependent protein kinase in metastatic colon carcinoma cells blocks tumor angiogenesis. Cancer, 112(7): 1462-1470.
- ^Weinberg R. A.1995. The retinoblastomas protein and cell cycle control. Cell, 81: 323-330.
- ^Fedi P., Tronick S. R., Aaronson S. A. 1997. Growth factors in cancer medicine. Williams & Wilkins, 41-64.
- ^Medema R. H., Bos J. L. 1993. The role of p21-ras in receptor tyrosine kinase signaling. Crit Rev Oncog, 4: 615-661.
- ^Reya T., Morrison S. J., Clarke M. F., Welssman I. L. 2001. Stem cells, cancer and cancer stem cells. Nature, 414: 105-111.
- ^Virchow R.1855. Editorial. Virchows Arch Pathol Anat Physiol Klin Med, 3: 23.
- ^Lapidot T., Sirard C., Vormoor J., Murdoch B., Hoang T., Careras-Cortes J., Minden M., Paterson B., Caligiuris M. A., Dick J. E. 1994. A cell initiating human acute myeloid leukemia after transplantation into SCID mice. Nature, 367: 645-648.
- ^OBrien C. A., Pollet A., Gallinger S., Dick J. E. 2007. A human colon cancer cell capable of initiating tumor growth in immunodeficient mice. Nature, 445: 106-110.
- ^Clarke M. F., Dick J. E., Dirks P. B., Eaves C. J., Jamieson C. H., Jones D. L., Visvader J., Weissman I. L., Wahi G. M. 2006. Cancer stem cells perspectives on current status and future directions: AACR workshop on cancer stem cells. Cancer Res., 66: 9339-9344.
- ^Allan A. L., Vantyghem S. A., Tuck A. B., Chambers A. F. 2007. Tumor dormancy and cancer stem cells: implications for the biology and treatment of breast cancer metastasis. Breast Dis., 26: 87-98.
- ^Barnhart B. C., Simon M. C. 2007. Metastasis and stem cell pathways. Cancer Metastasis Rev., 26: 261-271.
- ^Kucia M., Ratajczak M. Z. 2006. Stem cells as two edged sword from regeneration to tumor formation. J Physiol Pharmacol, 57: 5-16.
- ^Li F., Tiede B., Massagu J., Kang Y. 2007. Beyond tumorigenesis: cancer stem cells in metastasis. Cell Researh, 17: 3-14.
- ^Jaiswal S., Traver D., Miyamoto T. 2003. Expression of BCR/ABL and BCL-2 in myeloid progenitors leads to myeloid leukemias. Proc Natl Acad Sci USA, 100: 10002-10007.
- ^Rizvi A. Z., Swain J. R., Davies P. S. 2006. Bone marrow-derived cells fuse with normal and transformed intestinal stem cells. ProcNatl Acad Sci USA, 103: 6321-6325.
- ^Bjerkvig R., Tysnes B. B., Aboody K. S., Najbauer J., Terzis A. J. 2005. Opinion: the origin of the cancer stem cell: current controversies and new insights. Nat Rev Cancer, 5: 899-904.
- ^Duelli D., Lazebnik Y. 2007. Cell-to-cell fusion as a link between viruses and cancer. Nature Reviews Cancer, 7: 968-976.
- ^Murgia C., Pritchard J. K., Kim S. Y., Fassati A., Weiss R. A. 2006. Clonal origin and evolution of a transmissible cancer. Cell,. 126(3): 477-487.